BTK-Inhibitoren im direkten Vergleich: Daten, die die Praxis verändern
Im Head-to-Head-Vergleich mit Ibrutinib hat sich der Zweitgenerations-BTKi Acalabrutinib als gleich wirksam, aber besser verträglich erwiesen. Im Fokus steht dabei vor allem die Kardiotoxizität.
Neuer BTKi seit Ende 2020 verfügbar
Seit Ende 2020 steht in Deutschland mit Acalabrutinib (Calquence®) ein Bruton-Tyrosinkinase-Inhibitor (BTKi) der zweiten Generation für die Behandlung von Patient:innen mit chronischer lymphatischer Leukämie (CLL) zur Verfügung.1 Schon vor seiner EU-Zulassung, die maßgeblich auf den Daten der Phase-III-Studien ELEVATE-TN2 und ASCEND3 basiert, wurde Acalabrutinib in die Onkopedia-Leitlinie der DGHO als ein weiterer BTKi neben Ibrutinib aufgenommen.4 Eine wertende Empfehlung wollten die Leitlinienautoren damals noch nicht abgeben, wie der medizinische Leiter der DGHO, Prof. Bernhard Wörmann, in einem Live-Webinar zu den wichtigsten Ergebnissen beim ASCO 2021 anmerkte.5 Mit dem Daten-Update zu Acalabrutinib, das beim weltgrößten, in diesem Jahr erneut virtuell abgehaltenen Kongress der American Society of Oncology (ASCO) präsentiert wurde, ist neue Evidenz hinzugekommen, die für einen präferierten Einsatz des Zweitgenerations-BTKi spricht.
ELEVATE-RR: direkter Vergleich zwischen Acalabrutinib und Ibrutinib
„Was es jetzt gibt, ist die erste Studie mit einem Head-to-Head-Vergleich“, so Wörmann mit Blick auf die Phase-III-Studie ELEVATE-RR6. Unter dem Titel „ASCO 2021 – Wichtig zu wissen“ haben DGHO-Experten Kongressbeiträge zusammengefasst und kommentiert, die „den Standard von Diagnostik und Therapie in den nächsten Jahren verändern können“.7 Der DGHO-Kommentar zu den Ergebnissen der Studie ELEVATE-RR, dem einzigen ausgewählten Beitrag zur CLL, lautet: „Die Studie bestätigt die vergleichbare Wirksamkeit von Acalabrutinib und von Ibrutinib. Die Rate belastender Nebenwirkungen ist niedriger unter Therapie mit Acalabrutinib.“8
„Wichtig zu wissen“: das Kernergebnis der Studie ELEVATE-RR
|
Patienten-kollektiv (n = 533)
|
Neue Therapie
|
Kontrolle
|
PFS
(Median in Monaten)
|
OS
(Median in Monaten)
|
Therapieabbruch aufgrund von UE
|
|
CLL, vorbehandelt, del(17p) oder del(11q)
|
Acalabrutinib
|
Ibrutinib
|
38,4 vs. 38,4
HR = 1,0
|
n. e. vs. n. e.
HR 0,82
(n. s.)
|
14,7 % vs. 21,3 %
|
Legende: HR = Hazard Ratio; n. e. = nicht erreicht; n. s. = nicht signifikant; PFS = progressionsfreies Überleben; OS = Gesamtüberleben; UE = unerwünschte Ereignisse
Zusammenfassung der ELEVATE-RR-Ergebnisse6
Klinisch besonders relevant: kardiovaskuläre Toxizität unter Ibrutinib
In den vergangenen Jahren führte die auch im langfristigen Follow-up bestätigte signifikante Wirksamkeit und verbesserte Verträglichkeit von Ibrutinib im Vergleich mit den üblichen Chemoimmuntherapie-Regimes zu einem Paradigmenwandel zugunsten von zielgerichteten Therapien als bevorzugter Behandlungsoption für die meisten CLL-Patient:innen.9-12 Mit der längeren Nachbeobachtungszeit machten sich unter der Therapie mit Ibrutinib allerdings auch vermehrt klinisch relevante Toxizitäten wie Vorhofflimmern (11–16 %) und Bluthochdruck (20–26 %) bemerkbar.9-10 Angesichts eines medianen Erkrankungsalters von 72 bzw. 75 Jahren (Männer bzw. Frauen) spielen bei CLL-Patient:innen gerade kardiovaskuläre Risikofaktoren eine besondere Rolle, wenn es um Komorbiditäten und Unterschiede im Nebenwirkungsprofil der verfügbaren Therapeutika geht.
Eine retrospektive Analyse zeigte, dass im realen Versorgungsalltag fast jede(r) vierte Patient:In (23 %) eine Ibrutinib-Therapie aufgrund von toxischen Effekten vorzeitig abbricht.13 In zentralen langfristigen Phase-III-Studien kam es bei 21 % der zuvor unbehandelten Patient:innen (RESONATE-2; medianes Follow-up: 60 Monate)10 bzw. bei 12 % der Patienten mit CLL-Rezidiv (RESONATE; medianes Follow-up: 44 Monate)9 zu einem nebenwirkungsbedingten Therapieabbruch unter Ibrutinib, dagegen nur bei bis zu 11 % unter Acalabrutinib.2,3 Der direkte Vergleich bestätigt nun diesen Unterschied: Therapieabbrüche aufgrund von unerwünschten Ereignissen waren in der randomisierten, offenen Phase-III-Studie ELEVATE-RR im Acalabrutinib-Arm seltener zu beobachten als im Ibrutinib-Arm (14,7 % vs. 21,3 %).6
Acalabrutinib: stark wirksam bei differenziertem Verträglichkeitsprofil
In die ELEVATE-RR-Studie wurden 533 bereits vorbehandelte Patient:innen mit den zytogenetischen Merkmalen del(17p) oder del(11q) und ohne signifikante kardiovaskuläre Erkrankungen eingeschlossen. Sie erhielten entweder Acalabrutinib (n = 268) oder Ibrutinib (n = 265) als Monotherapie. Primärer Studienendpunkt war die Nichtunterlegenheit bezüglich des progressionsfreien Überlebens (PFS) gemäß Beurteilung durch ein unabhängiges Prüfgremium (IRC). Die vier sekundären Endpunkte umfassten die Inzidenz von Vorhofflimmern/-flattern jeden Grades, Infektionen Grad ≥ 3, Richter-Transformationen sowie das Gesamtüberleben.6
Nach einer medianen Nachbeobachtungszeit von 40,9 Monaten spricht das in beiden Studienarmen identische PFS (median 38,4 Monate) mit einer Hazard Ratio von 1,0 für eine ebenbürtige Wirksamkeit der beiden BTKi. Beim Gesamtüberleben (OS) zeigte sich ein leichter, nicht signifikanter Trend zugunsten von Acalabrutinib (Todesfälle: 23,5 % vs. 27,5 %). Während das mediane OS in beiden Studienarmen (Acalabrutinib vs. Ibrutinib) nicht erreicht wurde, waren ähnliche Inzidenzen für Infektionen Grad ≥ 3 (30,8 % vs. 30,0 %) und Richter-Transformationen (3,8 % vs. 4,9 %) zu verzeichnen.6
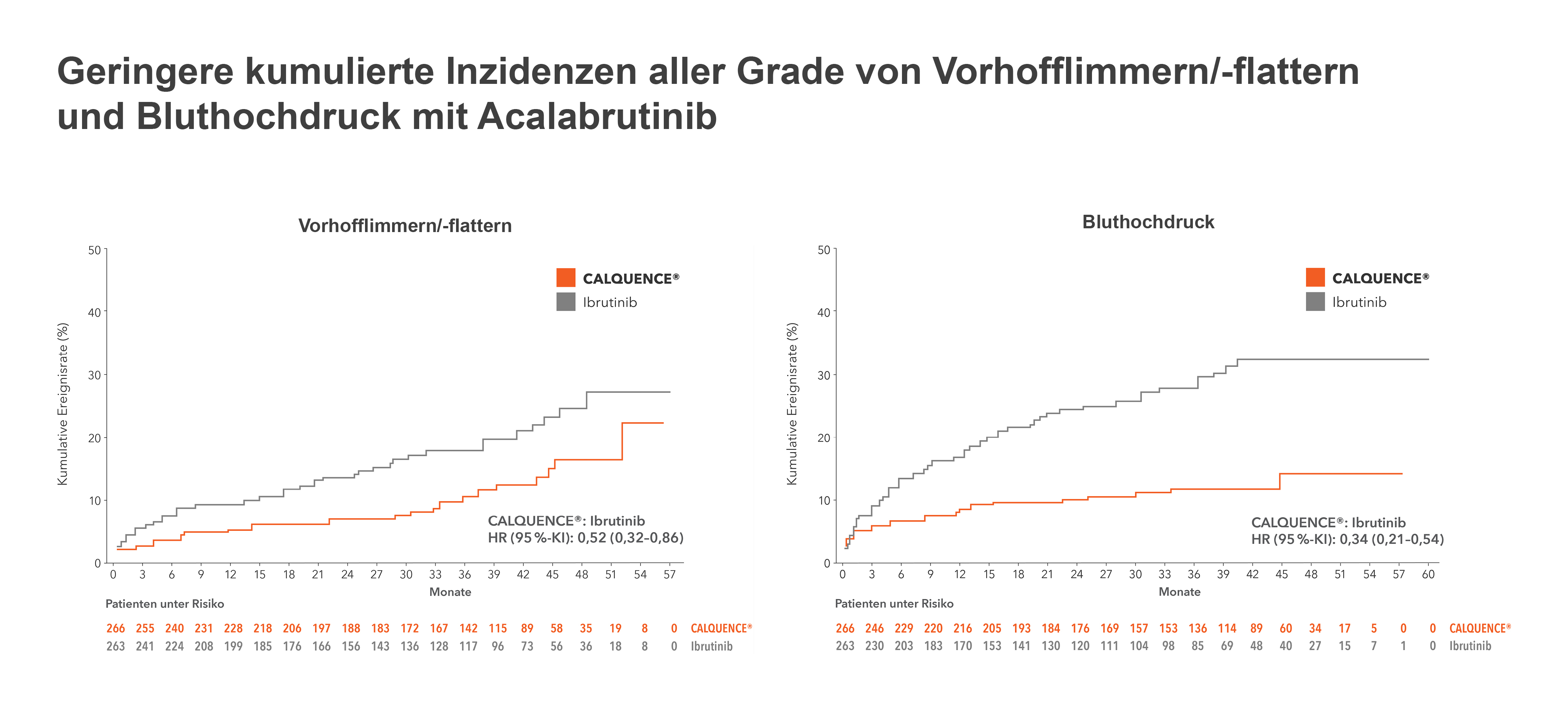
Statistisch signifikant seltener: Vorhofflimmern/-flattern und Hypertonie
Bei der Analyse unerwünschter Ereignisse von klinischem Interesse (≥ 10 % [alle Grade] oder ≥ 5 % [Grad ≥ 3] in jedem Behandlungsarm) ergaben sich statistische Unterschiede, jeweils zugunsten von Acalabrutinib vs. Ibrutinib, z. B. für
- Vorhofflimmern/-flattern (alle Grade): 9,4 % vs. 16,0 %;
- Blutungsereignisse (alle Grade): 38,0 % vs. 51,3 %;
- Hypertonie (alle Grade): 8,6 % vs. 22,8 %;
- Hypertonie (Grad ≥ 3): 4,1 % vs. 8,7 %;
- ILD/Pneumonitis (alle Grade): 2,6 vs. 6,5.
Unter Acalabrutinib traten signifikant weniger Fälle von Vorhofflimmern/-flattern aller Grade auf als unter Ibrutinib (bei 25 Patient:innen bzw. 9,4 % vs. 42 Patient:innen bzw. 16%; p = 0,02). Der absolute Unterschied von 6,6 % entspricht einer relativen Reduktion um 41 %. Die Zahl der Ereignisse pro 100 Personenmonate lag im Ibrutinib-Arm doppelt so hoch wie im Acalabrutinib-Arm (0,721 vs. 0,366). Neue Fälle von Vorhofflimmern/-flattern traten unter der Ibrutinib-Therapie sogar 2,4-mal häufiger als unter dem hochselektiven BTKi der zweiten Generation auf (15/243 Patient:innen vs. 37/249 Patient:innen bzw. 6,2 % vs. 14,9 %).6
Das Vorhofflimmern entwickelte sich unter der Therapie mit Ibrutinib zudem schneller. Die mediane Dauer bis zum Auftreten des Vorhofflimmerns (alle Grade) betrug unter dem BTKi der ersten Generation nur 16,0 Monate vs. 28,8 Monate unter Acalabrutinib. Bei jedem sechsten Patient:innen mit Vorhofflimmern/-flattern führte diese Nebenwirkung zum Therapieabbruch (7 von 42; 16,7 %), dagegen bei keinem Studienteilnehmer im Acalabrutinib-Arm.6
Therapeutisch geboten: Limitierung des VHF- und Hypertonie-Risikos
Der Mechanismus, der dem Ibrutinib-induzierten Vorhofflimmern (VHF) zugrunde liegt, ist Gegenstand aktueller Forschung. Eine im vergangenen Jahr publizierte Untersuchung an Mäusen, die mit Ibrutinib und Acalabrutinib behandelt wurden, konnte die durch Ibrutinib ausgelöste Inhibition der C-terminalen-Src-Kinase (CSK) als Mechanismus des Vorhofflimmerns identifizieren.14 Da VHF bekanntlich das Risiko für die kardiovaskuläre Mortalität und die Gesamtsterblichkeit erhöht15, ist die Limitierung des VHF-Risikos bei CLL- Patient:innen von hoher therapeutischer Relevanz.12
Ähnlich verhält es sich mit der Ibrutinib-assoziierten Hypertonie, für die ein Morbiditäts- und Mortalitätszusammenhang beschrieben wurde.6,16 Auch hier sind die Entstehungsmechanismen noch nicht gänzlich aufgeklärt. Im direkten Vergleich lag die Hypertonie-Inzidenz im Acalabrutinib-Arm jedenfalls deutlich niedriger als im Ibrutinib-Arm (s. o.).6
Geringere Inzidenz von Blutungen aller Grade und anderen Nebenwirkungen
Bekannt ist, dass die BTK – wie auch andere Kinasen der Tec-Familie – von Blutplättchen exprimiert wird und eine Rolle bei der Plättchenaktivierung spielt17-19 und die BTK-Inhibition die Thrombozytenadhäsion am Von-Willebrand-Faktor beeinträchtigt20. Bezüglich der Gefahr von Blutungen aller Grade erwies sich Acalabrutinib im Direktvergleich mit Ibrutinib als die verträglichere Therapieoption (s. o.)6, was insbesondere für Patient:innen mit antithrombotischer Medikation von Vorteil ist.12 Warfarin oder andere Vitamin-K-Antagonisten sollen nicht gleichzeitig mit Acalabrutinib angewendet werden.1
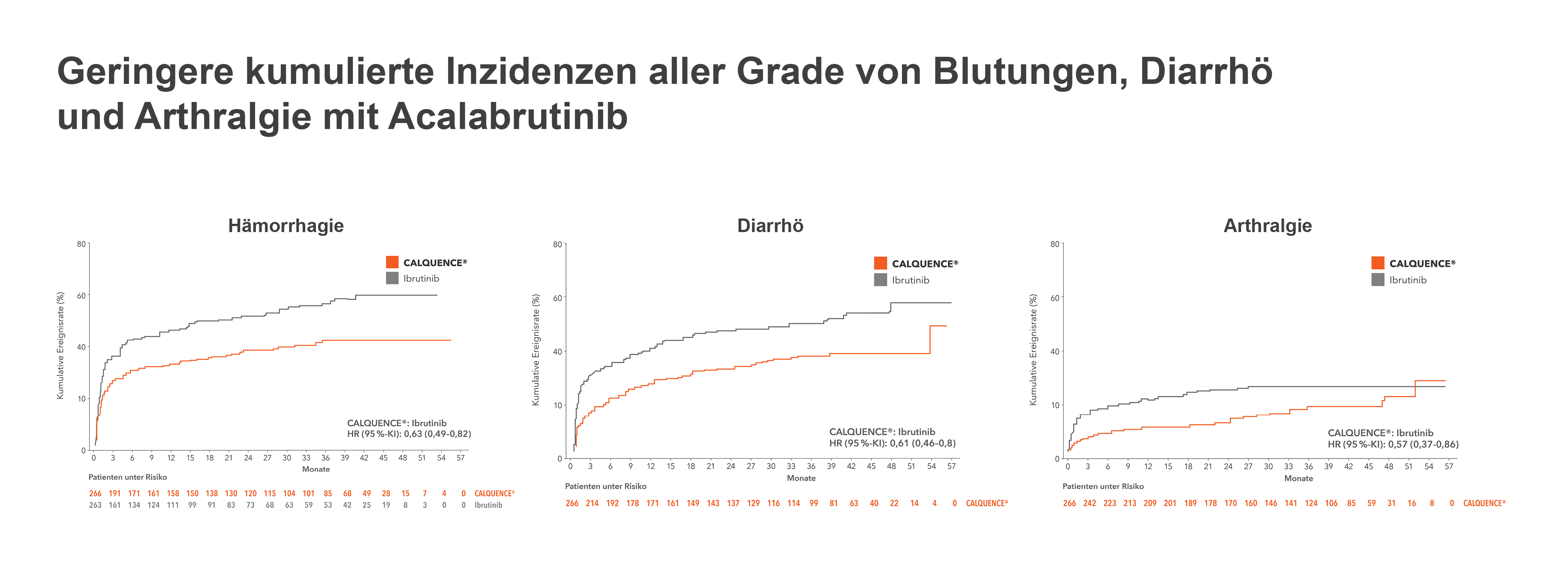
Mit der Ausnahme von Kopfschmerzen (alle Grade; Grad ≥ 3), Husten (alle Grade) und Fatigue (Grad ≥ 3) berichteten die mit Acalabrutinib behandelten Patient:innen auch sonst über eine insgesamt geringere Toxizität als die Teilnehmer im Ibrutinib-Arm, etwa bezüglich Diarrhö, Arthralgie, Kontusion, Rückenschmerz, Muskelspasmen und Dyspepsie.6
Insgesamt günstiges Verträglichkeitsprofil – auch im längeren Follow-up
Außer den ELEVATE-RR-Ergebnissen wurden beim ASCO 2021 mit dem 4-Jahres-Update der ELEVATE-TN-Studie noch weitere Daten präsentiert, die die Evidenz für Acalabrutinib als neuem Therapiestandard bei CLL untermauern: Neben der starken Wirksamkeit erwies sich auch das insgesamt günstige Verträglichkeitsprofil von Acalabrutinib mit niedrigen Raten an kardiovaskulären Ereignissen (Vorhofflimmern/-flattern und Bluthochdruck) und Therapieabbrüchen nach einem längeren Follow-up als konsistent.21
- Fachinformation Calquence®, Stand: Juni 2021
- Sharman JP et al. Acalabrutinib with or without obinutuzumab versus chlorambucil and obinutuzumab for treatment-naive chronic lymphocytic leukaemia (ELEVATE TN): a randomised, controlled, phase 3trial. Lancet 2020;395:1278-91
- Ghia P et al. ASCEND: Phase III, Randomized Trial of Acalabrutinib Versus Idelalisib Plus Rituximab or Bendamustine Plus Rituximab in Relapsed or Refractory Chronic Lymphocytic Leukemia. J Clin Oncol 2020;38(25):2849-61
- Wendtner CM et al. Onkopedia-Leitlinie Chronische Lymphatische Leukämie (CLL). Stand: September 2020
- ASCO 2021 – Wichtig zu wissen – Live Webinar am 11.06.2021. https://www.dgho.de/aktuelles/news/news/2021/asco-2021-wichtig-zu-wissen-live-webinar-am-11-06.2021 (Zugriff am 23.09.2021)
- Byrd JC et al. Acalabrutinib Versus Ibrutinib in Previously Treated Chronic Lymphocytic Leukemia: Results of the First Randomized Phase III Trial. J Clin Oncol 2021;JCO2101210
- DGHO. ASCO 2021 – Wichtig zu wissen. https://www.dgho.de/aktuelles/news/news/2021/asco-2021-wichtig-zu-wissen (Zugriff am 23.09.2021)
- DGHO. ASCO 2021 – Wichtig zu wissen. Chronische Lymphatische Leukämie (CLL). Acalabrutinib oder Ibrutinib bei Patient*innen mit vorbehandelter CLL (ELEVATE-RR, Byrd et al., Abstract 7500. https://www.dgho.de/aktuelles/news/news/2021/download/asco-2021-cll.pdf (Zugriff am 23.09.2021)
- Byrd JC et al. Long-term follow-up of the RESONATE phase 3 trial of ibrutinib vs ofatumumab. Blood 2019;133:2031-42
- Burger JA et al. Long-term efficacy and safety of first-line ibrutinib treatment for patients with CLL/SLL: 5 years of follow-up from the phase 3 RESONATE-2 study. Leukemia 2020;34:787-98
- Shanafelt TD et al. Ibrutinib-rituximab or chemoimmunotherapy for chronic lymphocytic leukemia. N Engl J Med 2019;381:432-43
- Stephens DM. Second-Generation Bruton’s Tyrosine Kinase Inhibitors: Simply the Best Treatments for Chronic Lymphocytic Leukemia? J Clin Oncol 2021;JCO2101414
- Sharman JP et al. Understanding Ibrutinib Treatment Discontinuation Patterns for Chronic Lymphocytic Leukemia. Blood 2017;130:4060
- Xiao L et al. Ibrutinib-Mediated Atrial Fibrillation Attributable to Inhibition of C-Terminal Src Kinase. Circulation 2020;142(25):2443-55
- Benjamin EJ et al. Impact of atrial fibrillation on the risk of death: The framingham Heart study. Circulation 1998;98:946-52
- Dickerson T et al. Hypertension and incident cardiovascular events following ibrutinib initiation. Blood 2019;134:1919-28
- Quek LS et al. A role for Bruton’s tyrosine kinase (Btk) in platelet activation by collagen. Curr Biol 1998;8:1137-40
- Futatani T et al. Bruton’s tyrosine kinase is present in normal platelets and its absence identifies patients with X-linked agammaglobulinaemia and carrier females. Br J Haematol 2001;114:141-9
- Liu J et al. Bruton tyrosine kinase is essential for botrocetin/VWF-induced signaling and GPIb-dependent thrombus formation in vivo. Blood 2006;108:2596-603
- Levade M et al. Ibrutinib treatment affects collagen and von Willebrand factor-dependent platelet functions. Blood 2014;124:3991-5
- Sharman JP et al. Acalabrutinib ± obinutuzumab versus obinutuzumab + chlorambucil in treatment-naïve chronic lymphocytic leukemia: Elevate-TN four-year follow up. J Clin Oncol 2021;39(15_suppl):7509
Abkürzungen:
ASCO = American Society of Clinical Oncology (bzw. deren Jahreskongress)
BTK = Bruton-Tyrosinkinase
BTKi = Bruton-Tyrosinkinase-Inhibitor
CLL = chronische lymphatische Leukämie
DGHO = Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie e. V.
ERBB2 = Erb-B2 Rezeptor-Tyrosin-Kinase 2
HR = Hazard Ratio
ILD = interstitielle Lungenerkrankung
OS = Gesamtüberleben
PFS = progressionsfreies Überleben
R/R = rezidiviert/refraktär
DE-40703/21

