Acalabrutinib: Daten-Update vom ASCO 2021
Beim ASCO 2021 präsentierte Daten bestätigen die starke Wirksamkeit und ein konsistentes Sicherheitsprofil des BTKi der 2. Generation, Acalabrutinib, bei einer medianen Nachbeobachtungszeit von vier Jahren.
Acalabrutinib (CALQUENCE®) wurde im November 2020 zugelassen als Monotherapie oder in Kombination mit Obinutuzumab zur Behandlung von erwachsenen Patienten mit nicht vorbehandelter chronischer lymphatischer Leukämie (CLL) und als Monotherapie zur Behandlung von erwachsenen Patienten mit CLL, die mindestens eine Vorbehandlung erhalten haben.1 Aufgrund der überzeugenden Daten der Phase III-Studien ELEVATE TN2 und ASCEND3, die ein überzeugendes Wirksamkeits- und Verträglichkeitsprofil von Acalabrutinib als Monotherapie oder in Kombination mit dem anti-CD20-Antikörper Obinutuzumab zeigten, wurde Acalabrutinib als ein neuer Therapiestandard in die aktuelle DGHO-Leitlinie aufgenommen.4
Starke Wirksamkeit und konsistentes Sicherheitsprofil in Erstlinie bei einem Betrachtungszeitraum von 4 Jahren
Die Zulassung von Acalabrutinib bei therapienaiven CLL-Patienten beruht auf den Ergebnissen der Studie ELEVATE TN.2 Die Phase III-Studie untersuchte die Wirksamkeit und Verträglichkeit von Acalabrutinib in Kombination mit Obinutuzumab (G) im Vergleich zur Chemoimmuntherapie mit G plus Chlorambucil (G + Clb). Die bisherigen Daten auf Basis einer medianen Nachbeobachtungszeit von 28,3 Monaten zeigten ein Überlegenheit der Acalabrutinib-Regime gegenüber G + Clb hinsichtlich des PFS. Diese Ergebnisse werden nun durch die Daten des Follow-ups nach 4 Jahren bestätigt: Nach einer medianen Nachbeobachtungszeit von 46,9 Monaten (0,0 – 59,9 Monate) betrug die PFS-Rate nach 48 Monaten für die Kombinationstherapie aus Acalabrutinib plus G 87 %.5 Nach einer medianen Nachbeobachtungszeit von 46,9 Monaten betrug die PFS-Rate nach 48 Monaten für die Kombinationstherapie Acalabrutinib plus G 87 % im Vergleich zu 25 % im Vergleich zu G + Clb (HR = 0,10 (95 %-Konfidenzintervall (KI): 0,07 – 0,17; p<0,0001) (Abbildung 1).
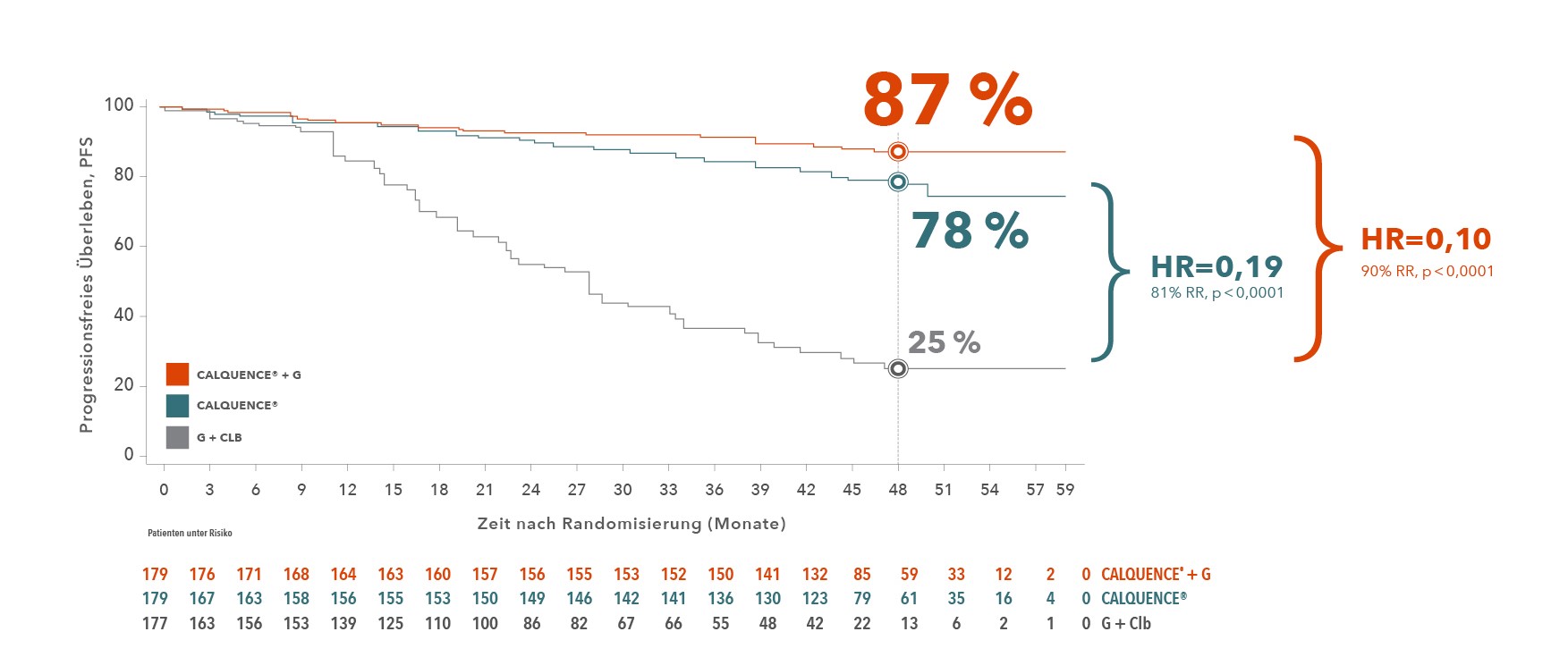
Abb. 1: ELEVATE TN: PFS nach 4 Jahren Follow-up (adaptiert nach Sharman et al. 2021).
Für die Acalabrutinib-Monotherapie ergab sich eine PFS-Rate von 78 % zu G + Clb (HR = 0,19 (95 %-KI: 0,13 – 0,28; p<0,0001). Mit der Acalabrutinib-Kombinationstherapie erreichten zudem mehr Patienten eine komplette Remission (Acalabrutinib+G: 30,7 %, Acalabrutinib: 11,2 %, G + Clb: 13,0 %) und MRD*-Negativität (Abbildung 2).
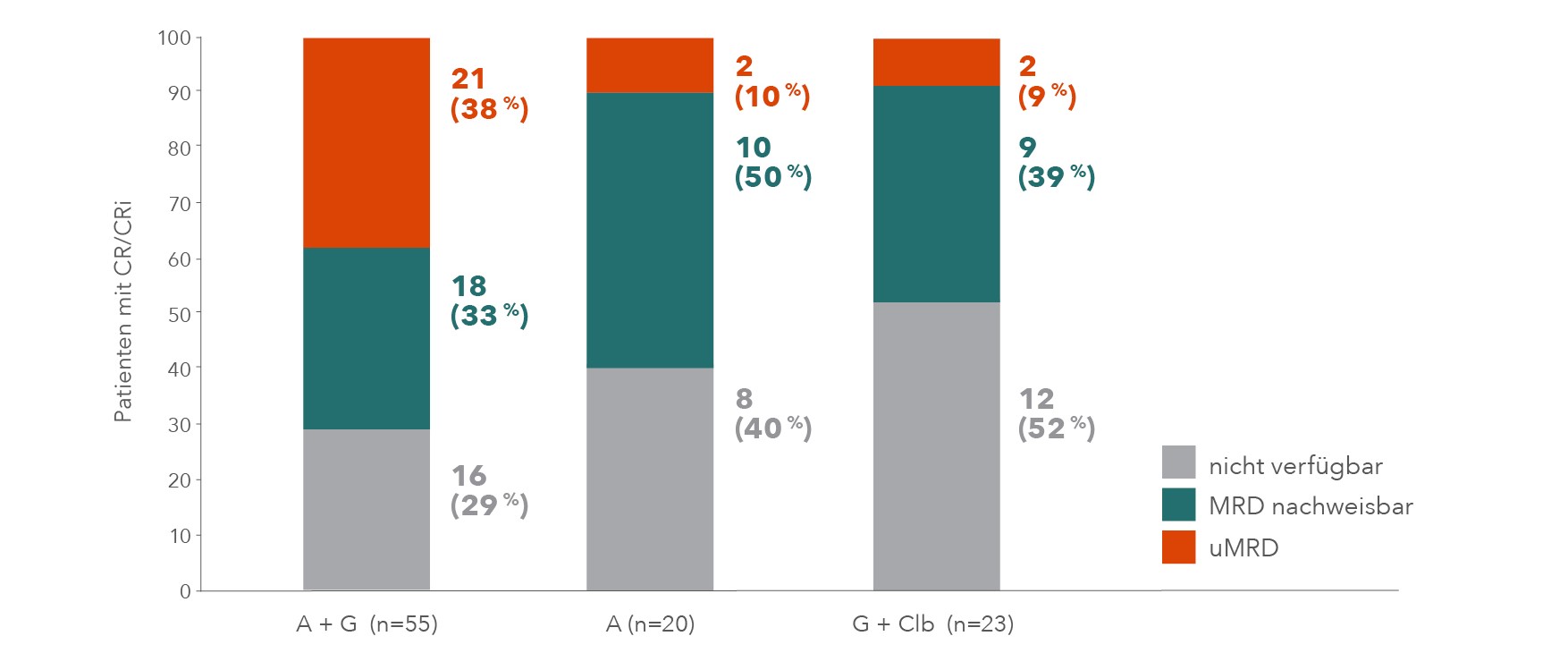
Abb. 2: ELEVATE TN: MRD-Status von Patienten in kompletter Remission (adaptiert nach Byrd et al. 2021).
* MRD (minimale Resterkrankung) war definiert als der Anteil der Patienten mit < 1 CLL-Zelle pro 104 Leukozyten
Patienten profitierten weiterhin über alle vordefinierten Subgruppen hinweg von einer PFS-Verlängerung unter den Acalabrutinib-Regimen. Zur Zeit der Analyse wurde das mediane Gesamtüberleben (OS) in keinem der Arme erreicht.
Nach einem längeren Follow-up zeigte sich ein konsistentes Sicherheitsprofil: Insgesamt waren die unerwünschten Ereignisse von klinischem Interesse, einschließlich kardiovaskulärer Ereignisse, in beiden Acalabrutinib-Armen ähnlich und konsistent mit früheren Ergebnissen. Zu den häufigsten unerwünschten Ereignissen (alle Grade) gehörten Infektionen, Kopfschmerzen, Diarrhö, Neutropenie, Müdigkeit und Kontusionen.
ELEVATE RR – BTKi im Head-to-Head-Vergleich
Die Rationale zur Entwicklung von Acalabrutinib ergab sich aus dem Bedarf zur Optimierung der BTKi-Therapie. Denn die Nebenwirkungen des BTKi der 1. Generation, Ibrutinib, können therapielimitierend sein.6-8 Die Ergebnisse von In vitro-Untersuchungen zur Kinasehemmung zeigten für Acalabrutinib im Vergleich zu Ibrutinib eine höhere Selektivität sowie weniger Off-Target-Effekte und wiesen damit auf ein möglicherweise andersartiges Verträglichkeitsprofil hin.10,11
Die randomisierte, multizentrische offene Phase III-Studie ELEVATE RR verglich Acalabrutinib mit dem BTKi der 1. Generation hinsichtlich der Wirksamkeit und Sicherheit.12 Eingeschlossen wurden 533 Patienten. Die vorbehandelten Patienten Sie durften einen ECOG-Status von ≤ 2 sowie die durch Laboruntersuchungen bestätigte Hochrisikomerkmale del(17p) oder del(11q) aufweisen. Das mediane Alter der Patienten betrug 66 Jahre. Bei 45 % lag eine del(17p) vor und bei 40 % eine TP53-Mutation. 86 % hatten einen unmutierten IGHV-Status.
Sie erhielten entweder Acalabrutinib (n=268) oder Ibrutinib (n=265) als Monotherapie. Primärer Endpunkt war das durch das IRC beurteilte PFS mit dem Ziel, die Nicht-Unterlegenheit von Acalabrutinib gegenüber Ibrutinib zu zeigen. Die sekundären Endpunkte wurden sequenziell in hierarchischer Reihenfolge getestet. Hierzu zählten primär die Inzidenz von Vorhofflimmern gefolgt von der Inzidenz therapiebedingter Infektionen vom Grad ≥ 3, die Inzidenz von Richter-Transformation sowie das Gesamtüberleben (OS).
Nicht-Unterlegenheit im PFS
Die Studie ELEVATE RR erreichte den primären Endpunkt: Das vom IRC beurteilte mediane PFS betrug 38,4 Monate bei einer medianen Nachbeobachtungszeit von 40,9 Monaten (0,0-59,1 Monate). Die Nicht-Unterlegenheit von Acalabrutinib konnte nachgewiesen werden bei einer Hazard Ratio (HR) von 1,0 (95 %-KI: 0,79 – 1,27).
Im wichtigen sekundären Endpunkt, der Inzidenz von Vorhofflimmern aller Grade, erzielte Acalabrutinib ein statistisch signifikantes und klinisch relevantes Ergebnis: Acalabrutinib zeigte im Vergleich zu Ibrutinib eine signifikant niedrigere Rate (9 % vs. 16 %; p=0,02) entsprechend einer Reduktion der Rate von Vorhofflimmern um 41 %.
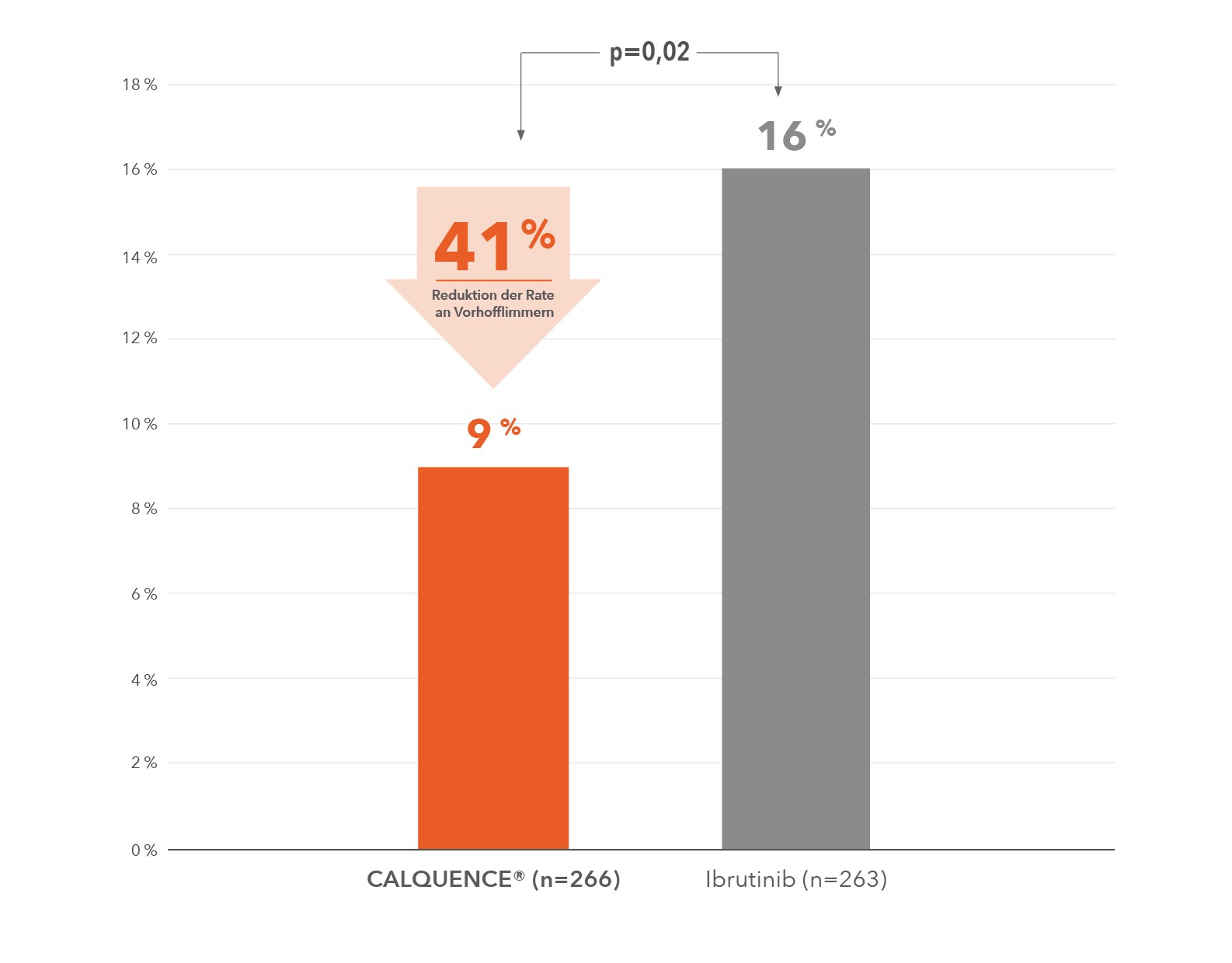
Abb. 3: ELEVATE RR: Acalabrutinib zeigte eine signifikante, geringere Inzidenz von Vorhofflimmern vs. Ibrutinib (adaptiert nach Byrd et al. 2021).
Bezüglich der weiteren sekundären Endpunkte ergab sich eine vergleichbare Inzidenz von Infektionen vom Grad ≥ 3 (Acalabrutinib: n=82 (30,8 %) vs. Ibrutinib (n=79 (30,0 %); p=0,8777) und von Richter-Transformationen (Acalabrutinib: n=10 (3,8 %) vs. Ibrutinib (n=13 (4,9 %)). Das OS nach 40,9 Monaten zeigt einen bei einer HR von 0,82 (95 %-KI: 0,59-1,15) einen numerischen Trend für ein längeres Gesamtüberleben unter Acalabrutinib im Vergleich zu Ibrutinib.
Differenziertes, insgesamt günstiges Sicherheitsprofil
Acalabrutinib zeigte in der ELEVATE RR im Vergleich zu Ibrutinib ein differenziertes Sicherheitsprofil mit geringeren Raten von Nebenwirkungen wie Diarrhö und Arthralgie. Auch die Raten von therapeutisch relevanten Ereignissen wie Blutungen aller Grade (Acalabrutinib: 101 (38,0 %); Ibrutinib: 135 (51,3 %)) oder Bluthochdruck alle Grade (Acalabrutinib: 25 (9,4 %); Ibrutinib: 61 (23,2 %) waren geringer als unter dem BTKi der 1. Generation. Acalabrutinib zeigte eine klinisch bedeutsame Reduktion von schweren unerwünschten Ereignissen aller Grade: Sie traten bei 53,8 % der mit Acalabrutinib behandelten Patienten und bei 58,6 % der mit Ibrutinib behandelten Patienten auf. Unerwünschte Ereignisse vom Grad 3 und mehr traten bei 68,8 % der mit Acalabrutinib behandelten Patienten und bei 74,9 % der mit Ibrutinib behandelten Patienten auf. Aufgrund von unerwünschten Ereignissen kam es zu einer erheblichen Reduktion der Therapieabbrüche aufgrund von unerwünschten Ereignissen (Acalabrutinib: 14,7 %; Ibrutinib: 21,3 %). Zum Studienende befanden sich 46,3 % der Patienten, die Acalabrutinib erhielten, und 41,1 % der Patienten, die Ibrutinib erhielten, weiter in Behandlung.
Fazit
- 4-Jahres-Follow-up der Studie ELEVATE TN: Bestätigkte starke Wirksamkeit und konsistentes Sicherheitsprofil von Acalabrutinib.
- ELEVATE RR ist die erste Head-to-Head-Studie zweier BTKi bei Patienten mit R/R-CLL und Hochrisiko-Merkmalen.
-
Acalabrutinib ist hinsichtlich des PFS im direkten Vergleich zu Ibrutinib nicht unterlegen.
- Bestätigtes differenziertes Sicherheits- und Verträglichkeitsprofil von Acalabrutinib bei einer statistisch signifikanten, geringeren Inzidenz von Vorhofflimmern.
- Acalabrutinib erfüllt den bislang ungedeckten Therapiebedarf durch Verbesserung des therapielimitierenden Nebenwirkungsprofils.
- Fachinformation CALQUENCE®, Stand November 2020.
- Sharman JP et al. Acalabrutinib with or without obinutuzumab versus chlorambucil and obinutuzumab for treatment-naive chronic lymphocytic leukaemia (ELEVATE TN): a randomised, controlled, phase 3 trial. Lancet 2020;395:1278-1291
- Ghia P et al. ASCEND: Phase III, Randomized Trial of Acalabrutinib Versus Idelalisib Plus Rituximab or Bendamustine Plus Rituximab in Relapsed or Refractory Chronic Lymphocytic Leukemia. J Clin Oncol. 2020;38:2849-2861.
- Wendtner CM, et al. Onkopedia-Leitlinie. Chronische Lymphatische Leukämie (CLL). Stand: September 2020. Online verfügbar unter: https://www.onkopedia.com/de/onkopedia/guidelines/chronische-lymphatische-leukaemie-cll/@@guideline/html/index.html (letzter Abruf: 16.6.2021)
- Sharman JP et al. Acalabrutinib ± obinutuzumab vs obinutuzumab + chlorambucil in treatment-naïve chronic lymphocytic leukemia: ELEVATE-TN 4-year follow-up. J Clin Oncol 2021; 39 (suppl 15; abstr 7509). DOI: 10.1200/JCO.2021.39.15_suppl.7509.
- Hampel PJ et al. Rapid disease progression following discontinuation of ibrutinib in patients with chronic lymphocytic leukemia treated in routine clinical practice. Leuk Lymphoma. 2019;60:2712-2719.
- Mato AR et al. Toxicities and outcomes of 616 ibrutinib-treated patients in the United States: a real-world analysis. Haematologica. 2018;103:874-879.
- Sharman JP et al. Understanding ibrutinib treatment discontinuation patterns for chronic lymphocytic leukemia. Blood. 2017;130:4060.
- Strati P et al. Relationship between co-morbidities at diagnosis, survival and ultimate cause of death in patients with chronic lymphocytic leukaemia (CLL): a prospective cohort study. Br. J Haematol 2017: 178: 394-402.
- Herman SEM et al. The Bruton tyrosine kinase (BTK) inhibitor acalabrutinib demonstrates potent on-target effects and efficacy in two mouse models of chronic lymphocytic leukemia. Clin Cancer Res. 2017;23:2831–2841.
- Kaptein A et al. Potency and selectivity of BTK inhibitors in clinical development for b-cell malignancies. Blood. 2018;132(suppl):1871.
- Byrd JC et al. First results of a head-to-head trial of acalabrutinib versus ibrutinib in previously treated chronic lymphocytic leukemia. J Clin Oncol 2021; 39 (suppl 15; abstr 7500). DOI: 10.1200/JCO.2021.39.15_suppl.7500.
Abkürzungen:
BTKi = Bruton-Tyrosinkinase-Inhibitor
CLL = chronische lymphatische Leukämie
HR = Hazard Ratio
MRD = minimale Resterkrankung
OS = Gesamtüberleben
PFS = progressionsfreies Überleben
R/R = rezidiviert/refraktär
DE-36989/21


