Von Ibrutinib zu Acalabrutinib: Was bringt die Umstellung?
Nebenwirkungen und Unverträglichkeiten setzen der Therapie mit dem Erstgenerations-BTKi Ibrutinib enge Grenzen. Ein Wechsel auf den Nachfolger Acalabrutinib kann sich lohnen.
Kernpunkte:
- Bei CLL-Patienten, die die Behandlung mit Ibrutinib nicht vertragen, kann mit Acalabrutinib eine dauerhafte Krankheitskontrolle erreicht werden.1-3
- Die meisten Nebenwirkungen, die Ibrutinib verursacht, treten unter Acalabrutinib nicht wieder auf.1-3
- Nach einem Abbruch der Ibrutinib-Therapie kann mit Acalabrutinib eine hohe Ansprechrate erreicht werden.1 Dies gilt auch für Patientinnen und Patienten mit R/R-CLL.2,3
Das zunehmende pathophysiologische Verständnis der chronischen lymphatischen Leukämie hat in den letzten Dekaden zu einer Reihe an neuen Therapieansätzen geführt, die auf die spezifische Hemmung bestimmter Signalwege zielen. Einer davon ist die Blockade der Bruton-Tyrosinkinase (BTK), die eine zentrale Rolle in der Pathogenese der CLL spielt.4 Die Einführung von Ibrutinib, dem ersten Vertreter der neuen BTK-Inhibitoren, brachte dann auch erhebliche Fortschritte in der Therapie der CLL. Als orale Therapieoption für Patienten sowohl mit neu diagnostizierter als auch mit rezidivierter/refraktärer CLL (R/R-CLL) verbesserte Ibrutinib die Behandlungsergebnisse maßgeblich.5-7
„Unmet need“ trotz bahnbrechender Erfolge
Doch neben den Therapieerfolgen kamen in der klinischen Anwendung bald auch die Schattenseiten des hocheffektiven Wirkstoffs zum Tragen. So setzen teils schwere unerwünschte Nebenwirkungen der Behandlung mit Ibrutinib Grenzen. Insbesondere Vorhofflimmern, Arthralgien, Hautausschlag, Durchfall und Blutungen führen in der Praxis bei bis zu einem knappen Viertel der Patientinnen und Patienten zu einem Abbruch der Behandlung.8-10
In einem zweiten Anlauf machten sich Forscher daher daran, das Wirkprofil der BTK-Inhibitoren zu präzisieren. Denn neben der Bruton-Tyrosinkinase hemmt Ibrutinib zahlreiche weitere Kinasen und Übertragungswege, was u. a. zu einer Beeinflussung von T-Lymphozyten, Makrophagen und Blutplättchen führt (sogenannte Off-Target-Effekte).11-13
Zweite Generation mit verbessertem Risikoprofil
Mit Acalabrutinib (Calquence®) ging im November 2020 eine neue Generation von BTKi an den Start, die sich gegenüber dem Vorgänger durch eine noch größere Selektivität auszeichnet. Die Off-Target-Aktivität von Acalabrutinib ist minimal, entsprechend gering der Einfluss auf Nicht-Zielzellen.14
Inzwischen hat sich auch der klinische Nutzen dieser verbesserten pharmakologischen Wirkweise gezeigt. Im direkten Head-to-Head-Vergleich mit Ibrutinib wies sein Nachfolger bei vergleichbarer Wirksamkeit ein signifikant reduziertes Risiko für Arrhythmien und hypertensive Ereignisse auf; ebenso traten Harnwegsinfekte, Arthralgien und Diarrhoen unter Acalabrutinib seltener auf.15 Die bessere Verträglichkeit zahlte sich auch für die Therapieadhärenz aus: Im Vergleich zu Ibrutinib brachen weniger Betroffene die Behandlung mit Acalabrutinib ab.15
Diese starken Ergebnisse führten dazu, dass Zweitgenerations-BTKi in der Onkopedia-Leitlinie inzwischen fest verankert sind. Seit der letzten Überarbeitung im Januar 2023 ist Calquence® für alle CLL-Patienten ab der First-line primäre Behandlungsoption.16
Praxischeck: Switch innerhalb der Substanzklasse
Aufgrund der guten Verträglichkeit von Acalabrutinib bei gleichzeitig überzeugender Wirksamkeit (geschätzte 60-Monate-PFS-Raten von bis zu 84 %, Gesamtansprechrate (ORR) von bis zu 96,1 %17) stellt sich die Frage, ob Betroffene, die Ibrutinib aufgrund von unerwünschten Ereignissen (UE) absetzen, klinisch weiterhin von einem selektiveren BTK-Inhibitor profitieren können.
Zwei Untersuchungen widmeten sich dieser Frage – und kamen beide zu klaren Ergebnissen.
ACE-CL-001 und ACE-CL-208 im Überblick:
ACE-CL-0011
Phase-I/II-Studie Acalabrutinib Monotherapie bei CLL-Kohorte mit Ibrutinib-Intoleranz
- n=33
- medianes Alter: 64 Jahre
- mediane Dauer bis zum Abbruch der Ibrutinib-Therapie aufgrund eines UE: 11,6 Monate
- mediane Behandlungsdauer mit Calquence®: 19 Monate
- primärer Endpunkt: Verträglichkeit (mit Häufigkeit, Schweregrad und Zuordnung der UE)
ACE-CL-2082,3
Phase-II-Studie Acalabrutinib Monotherapie bei R/R-CLL-Patienten mit Ibrutinib-Intoleranz
- n=60
- medianes Alter: 70 Jahre
- mediane Dauer bis zum Abbruch der Ibrutinib-Therapie aufgrund eines UE: 6 Monate
- mediane Behandlungsdauer mit Calquence®: 35 Monate
- primärer Endpunkt: ORR nach den modifizierten iwCLL-2008-Kriterien18
Hohe Therapieadhärenz im zweiten Anlauf
In der Studie ACE-CL-0011 wurde eine Kohorte von 33 Patienten nach nebenwirkungsbedingtem Abbruch der Ibrutinib-Therapie auf eine Monotherapie mit Acalabrutinib umgestellt. Nach einem Median von 19 Monaten nahmen noch 23 Patienten (70 %) das Medikament weiterhin ein. Eine Dosisreduktion war bei keinem der Probanden erfolgt. 10 hatten die Behandlung abgebrochen, davon jedoch nur 3 aufgrund von Nebenwirkungen durch Acalabrutinib. Das heißt, von denjenigen, die Ibrutinib nicht vertrugen und absetzten, machten weniger als 10 % mit Acalabrutinib die gleiche Erfahrung.
Von den 61 Nebenwirkungen, die unter Ibrutinib beklagt wurden, traten 72 % bei der Folgetherapie nicht erneut auf; 13 % kehrten zwar wieder, allerdings in einem niedrigeren Schweregrad. Die häufigsten unerwünschten Ereignisse, die unter Acalabrutinib auftraten, waren geringfügig (Grad ≤2).
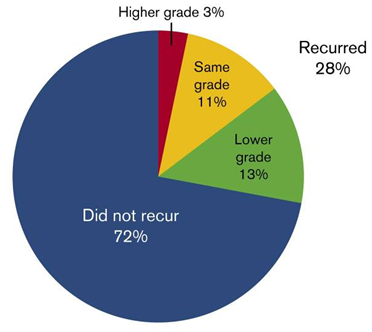
Abb. 1: Wiederauftreten von Ibrutinib-bedingten Nebenwirkungen während der Behandlung mit Acalabrutinib.1
Bleibende Wirksamkeit nach Umstellung auf Acalabrutinib
Die Gesamtansprechrate unter Calquence® betrug 76 %, darunter 1 vollständiges Therapieansprechen und 24 partielle. Bei den 25 Respondern wurde die mediane Dauer des Ansprechens nicht erreicht, ebenso wie das mediane progressionsfreie Überleben (PFS). Das 1-Jahres-PFS betrug 83,4 % (95 % Konfidenzintervall 64,5–92,7 %).
Dem klinischen Bild entsprachen auch die Ergebnisse auf pharmakodynamischer Ebene. Die mediane BTK-Besetzung betrug 4 Stunden nach der Medikamenteneinnahme nahezu 100 % und erreichte damit ähnliche Ergebnisse wie bei BTK-Inhibitor-naiven Patienten mit R/R-CLL, die Acalabrutinib erhielten.19 Entsprechend gehemmt wurde die BCR-vermittelte BTK-Phosphorylierung, ein Indiz für die pharmakologische Aktivität von Acalabrutinib.
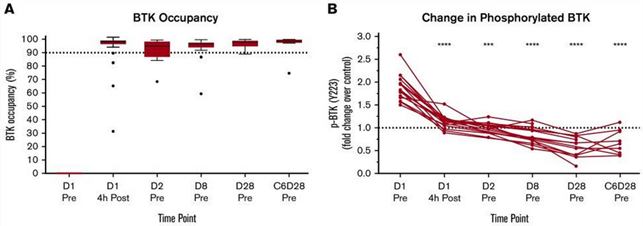
Abb. 2: (A) BTK-Besetzung nach Medikamenteneinnahme. (B) BCR-vermittelte BTK-Phosphorylierung.1
Therapiewechsel bei R/R-CLL
Die Studie ACE-CL-2082,3 verfolgte einen ähnlichen Ansatz. Auch hier ging es insbesondere darum, die Verträglichkeit von Acalabrutinib bei Patienten zu ermitteln, die Ibrutinib aufgrund von Toxizität zuvor abgesetzt hatten. Die Studienpopulation umfasste hier jedoch ausschließlich Patienten mit refraktärer oder rezidivierender CLL. Sie hatten mindestens eine Vortherapie erhalten. Die letzte, unmittelbar vorausgegangene, mit Ibrutinib wurde wiederum aufgrund unerwünschter Nebenwirkungen abgebrochen. Im Sinne der iwCLL-2008-Kriterien18 erlitten daraufhin alle 60 Studienteilnehmer eine Progression.
Nach einer medianen Behandlungsdauer mit Calquence® von 35 Monaten betrug die Gesamtansprechrate (ORR) 73 %. Weder für das progressionsfreie Überleben (PFS) noch für das Gesamtüberleben (OS) wurde der Median von 50 % erreicht – für die Studienautoren ein Beleg für eine dauerhafte Krankheitskontrolle durch die Behandlung mit Acalabrutinib. Zudem vermuten sie mit zunehmender Behandlungszeit einen weiteren Anstieg der ORR inklusive Vollremissionen (CR).
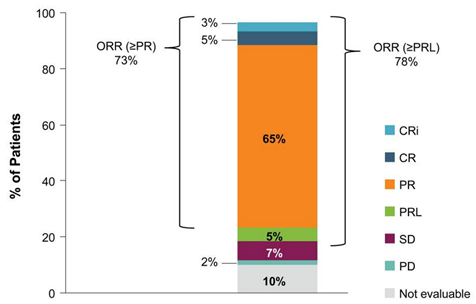
Abb.3: Ansprechen auf Acalabrutinib. CR: complete remission; Cri: CR with incomplete bone marrow recovery; ORR: overall response rate; PD: progressive disease; PR: partial remission; PRL: partial remission with lymphocytosis; SD: stable disease.2,3
Nebenwirkungen sistierten oder wurden milder
Auch die Verträglichkeit der erneuten BTKi-Therapie wurde bestätigt. Nach einer medianen Nachbeobachtungszeit von 35 Monaten setzte noch fast die Hälfte der Patienten die Behandlung fort. Häufigster Grund für das Absetzen von Acalabrutinib war das Fortschreiten der Erkrankung; aufgrund von Nebenwirkungen brachen nur 17 % die Behandlung ab. Das bedeutet, dass von den 100 %, die Ibrutinib nicht vertrugen, weniger als 1/5 dieselben Probleme mit Acalabrutinib hatten.
27 unerwünschte Ereignisse traten unter der Folgebehandlung dennoch erneut auf, davon am häufigsten Durchfall und Blutungen. Die meisten (67 %) waren allerdings von einem geringeren Schweregrad als zuvor unter Ibrutinib. Nur ein Ereignis (ein erhöhter Leberfunktionstest) war schwerwiegender.
|
Nebenwirkungen
|
Anzahl an Patienten mit Ibrutinib-Intoleranz
|
Erfahrungen derselben Patienten mit Acalabrutinib
|
|
gesamt
|
niedrigerer Schweregrad
|
gleicher Schweregrad
|
höherer Schweregrad
|
|
Vorhofflimmern
|
16
|
2
|
2
|
0
|
0
|
|
Diarrhoe
|
7
|
5
|
3
|
2
|
0
|
|
Hautausschlag
|
7
|
3
|
3
|
0
|
0
|
|
Blutung
|
6
|
5
|
3
|
2
|
0
|
|
Arthralgie
|
7
|
2
|
1
|
1
|
0
|
|
gesamt
|
41
|
24
|
18
|
6
|
1
|
Abb. 4: Häufigste Nebenwirkungen von Ibrutinib, die unter Acalabrutinib erneut auftraten. Adaptiert nach Rogers KA et al., 2021.2
Fallberichte bestätigen erfolgreiche Therapieumstellung
Ein Wechsel innerhalb der Substanzklasse von einem BTKi der ersten auf die zweite Generation hat sich auch in der klinischen Praxis immer wieder bewährt, wie einzelne Fallberichte zeigen. Etwa der eines 71-jährigen Patienten mit Niedrigrisiko-CLL, der unter der Behandlung mit Ibrutinib eine Pneumonitis mit Reizhusten und Dyspnoe entwickelte. Prof. Barbara Eichhorst, Oberärztin der Klinik I für Innere Medizin der Uniklinik Köln, entschied sich für eine Umstellung auf Calquence®. Mit Erfolg: Der Patient sprach gut auf die Behandlung an, der Reizhusten sistierte.20
„Das hätten wir sicher auch versucht – auch, um die Substanzklasse nicht zu verwerfen“, bestätigte Prof. Georg Heß, stellvertretender Direktor der III. Medizinischen Klinik und Poliklinik der Universität Mainz, bei einer Podiumsdiskussion anlässlich des DGHO-Kongresses 2021.20 Und berichtete selbst von einem Fall eines Patienten, der unter Ibrutinib eine Anämie entwickelte. Nach der Umstellung auf Acalabrutinib erholte sich der Hämoglobinwert wieder.
Calquence® 100 mg Filmtabletten/Calquence® 100 mg Hartkapseln
▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden.
Wirkstoff: Acalabrutinib. Verschreibungspflichtig. Zusammensetzung: Calquence 100 mg Filmtabletten: Jede Filmtablette enthält 100 mg Acalabrutinib (als Acalabrutinibmaleat). Calquence 100 mg Hartkapseln: Jede Hartkapsel enthält 100 mg Acalabrutinib. Sonstige Bestandteile: Calquence 100 mg Filmtabletten: Tablettenkern: Mannitol (Ph.Eur.) (E421), Mikrokristalline Cellulose (E460), niedrig substituierte Hydroxypropylcellulose (E463), Natriumstearylfumarat (Ph.Eur.); Filmüberzug: Hypromellose (E464), Copovidon, Titandioxid (E171), Macrogol (3350), mittelkettige Triglyceride, Eisen(III)-hydroxid-oxid x H2O (E172), Eisen(III)-hydroxid-oxid x H2O (E172). Calquence 100 mg Hartkapseln: Kapselinhalt: Mikrokristalline Cellulose (E460), hochdisperses Siliciumdioxid, vorverkleisterte Stärke (Mais), Magnesiumstearat (E470b), Poly(O-carboxymethyl)stärke-Natriumsalz; Kapselhülle: Gelatine, Titandioxid (E171), Eisen(III)-hydroxid-oxid x H2O (E172), Indigocarmin (E132); Drucktinte: Schellack, Eisen(II,III)-oxid (E172), Propylenglycol (E1520), Ammoniak-Lösung. Anwendungsgebiete: Calquence als Monotherapie oder in Kombination mit Obinutuzumab ist zur Behandlung von erwachsenen Patienten mit nicht vorbehandelter chronischer lymphatischer Leukämie (CLL) indiziert. Calquence als Monotherapie ist zur Behandlung von erwachsenen Patienten mit chronischer lymphatischer Leukämie (CLL) indiziert, die mindestens eine Vorbehandlung erhalten haben. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile. Nebenwirkungen: Monotherapie: Sehr häufig: Infektion der oberen Atemwege, Sinusitis, sekundäre Primärtumoren, Neutropenie, Anämie, Kopfschmerzen, Schwindel, Hämatom, Prellungen, Petechien, Hämorrhagie/Hämatom, Diarrhoe, Übelkeit, Verstopfung, Erbrechen, Abdominalschmerzen, Hautausschlag, muskuloskelettale Schmerzen, Arthralgie, Fatigue, Hämoglobin verringert, absolute Neutrophilenzahl verringert, Thrombozyten verringert. Häufig: Pneumonie, Harnwegsinfektion, Nasopharyngitis, Bronchitis, Herpes-Virus-Infektionen, nichtmelanozytärer Hautkrebs, sekundäre Primärtumoren (ohne nichtmelanozytären Hautkrebs), Thrombozytopenie, Vorhofflimmern/-flattern, Ekchymose, gastrointestinale Blutung, intrakranielle Blutung, Hypertonie, Epistaxis, Asthenie. Gelegentlich: Aspergillus-Infektionen, Hepatitis-B-Reaktivierung, Lymphozytose, Tumorlyse-Syndrom. Kombinationstherapie: Sehr häufig: Infektion der oberen Atemwege, Sinusitis, Nasopharyngitis, Harnwegsinfektion, Pneumonie, sekundäre Primärtumoren, Neutropenie, Thrombozytopenie, Anämie, Kopfschmerzen, Schwindel, Hämatom, Prellungen, Petechien, Hämorrhagie/Hämatom, Hypertonie, Diarrhoe, Übelkeit, Verstopfung, Erbrechen, Abdominalschmerzen, Hautausschlag, muskuloskelettale Schmerzen, Arthralgie, Fatigue, absolute Neutrophilenzahl verringert, Thrombozyten verringert, Hämoglobin verringert. Häufig: Bronchitis, Herpes-Virus-Infektionen, nichtmelanozytärer Hautkrebs, sekundäre Primärtumoren (ohne nichtmelanozytären Hautkrebs), Vorhofflimmern/-flattern, Ekchymose, gastrointestinale Blutung, Epistaxis, Asthenie. Gelegentlich: progressive multifokale Leukoenzephalopathie, Hepatitis-B-Reaktivierung, Lymphozytose, Tumorlyse-Syndrom, intrakranielle Blutung. Sehr selten: Aspergillus-Infektionen. Weitere Hinweise: siehe Fachinformationen. Pharmazeutischer Unternehmer: AstraZeneca GmbH, Friesenweg 26, 22763 Hamburg, E-Mail: azinfo@astrazeneca.com, www.astrazeneca.de, Servicehotline für Produktanfragen: 0800 22 88 660. Stand: August 2023.
DE-61418/2023
- Awan FT, Schuh A, Brown JR et al. Acalabrutinib monotherapy in patients with chronic lymphocytic leukemia who are intolerant to Ibrutinib. Blood Adv. 2019;3(9):1553-1562.
- Rogers KA et al. Phase 2 study of acalabrutinib in ibrutinib-intolerant patients with relapsed/refractory chronic lymphocytic leukemia. Haematologica 2021;doi: 10.3324/haematol.2020.272500.
- Rogers K, Thompson PA, Allan JN et al. Phase 2 study of acalabrutinib in ibrutinib (IBR)-intolerant patients (pts) with relapsed/refractory (R/R) chronic lymphocytic leukemia (CLL). J Clin Oncol 37, 2019 (suppl; abstr 7530).
- Byrd JC, Jones JJ, Woyach JA, Johnson AJ, Flynn JM. Entering the era of targeted therapy for chronic lymphocytic leukemia: impact on the practicing clinician. J Clin Oncol. 2014;32(27):3039-3047.
- Byrd JC, Furman RR, Coutre SE, et al. Targeting BTK with ibrutinib in relapsed chronic lymphocytic leukemia. N Engl J Med. 2013;369(1):32-42.
- Byrd JC, Brown JR, O’Brien S, et al.; RESONATE Investigators. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N Engl J Med. 2014;371(3):213-223.
- Burger JA, Tedeschi A, Barr PM, et al.; RESONATE-2 Investigators. Ibrutinib as initial therapy for patients with chronic lymphocytic leukemia. N Engl J Med. 2015;373(25):2425-2437.
- Mato AR, Nabhan C, Thompson MC et al. Toxicities and outcomes of 616 ibrutinib-treated patients in the United States: a real-world analysis. Haematologica. 2018;103(5):874-879.
- Sharman JP, Black-Shinn JL, Clark J et al. Understanding Ibrutinib Treatment Discontinuation Patterns for Chronic Lymphocytic Leukemia. Blood [ASH Abstract]. 2017;130:4060.
- Hampel PJ, Ding W, Call TG et al. Rapid disease progression following discontinuation of ibrutinib in patients with chronic lymphocytic leukemia treated in routine clinical practice. Leuk Lymphoma. 2019;60(11):2712-2719.
- Smith-Garvin JE, Koretzky GA, Jordan MS. T cell activation. Annu Rev Immunol. 2009;27(1):591-619.
- Feng M, Chen JY, Weissman-Tsukamoto R, et al.. Macrophages eat cancer cells using their own calreticulin as a guide: roles of TLR and Btk. Proc Natl Acad Sci USA. 2015;112(7):2145-2150.
- Senis YA, Mazharian A, Mori J. Src family kinases: at the forefront of platelet activation. Blood. 2014;124(13):2013-2024.
- Barf T, Covey T, Izumi R, et al.. Acalabrutinib (ACP-196): a covalent Bruton tyrosine kinase inhibitor with a differentiated selectivity and in vivo potency profile. J Pharmacol Exp Ther. 2017;363(2):240-252.
- Byrd JC, Hillmen P, Ghia P, et al. Acalabrutinib versus ibrutinib in previously treated chronic lymphocytic leukemia: results of the first randomized phase III trial. J Clin Oncol. 2021;39(31):3441–3452.
- Wendtner CM et al. Onkopedia-Leitlinie Chronische Lymphatische Leukämie (CLL). Stand: Januar 2023. Online unter: https://www.onkopedia.com/de/onkopedia/guidelines/chronische-lymphatische-leukaemie-cll/@@guideline/html/index.html (letzter Zugriff: Juli 2023).
- Sharman JP et al. Acalabrutinib ± obinutuzumab versus obinutuzumab + chlorambucil in treatment-naïve chronic lymphocytic leukemia: Five-year follow-up of ELEVATE-TN. J Clin Oncol 2022;40:7539.
- Hallek M, Cheson BD, Catovsky D et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines Blood. 2008;111(12):5446-5456.
- Byrd JC, Harrington B, O’Brien S, et al.. Acalabrutinib (ACP-196) in relapsed chronic lymphocytic leukemia. N Engl J Med. 2016;374(4):323-332.
- Satelliten-Symposium „CLL interdisziplinär – eine Podiumsdiskussion“ im Rahmen der Jahrestagung der Deutschen, Österreichischen und Schweizerischen Gesellschaft für Hämatologie und Medizinische Onkologie am 02.10.2021, veranstaltet von AstraZeneca GmbH.
Abkürzungen:
BTK = Bruton-Tyrosinkinase
BTKi = Bruton-Tyrosinkinase-Inhibitor
CLL = Chronische lymphatische Leukämie
CR = complete remission
DGHO = Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie
ORR = overall response rate
OS = overall survival
PFS = progression-free survival
R/R-CLL = rezidivierte/refraktäre chronische lymphatische Leukämie
DE-61145/23


