Acalabrutinib bei CLL: belegte Wirksamkeit auch nach 5 Jahren
Seit seiner Zulassung vor über zwei Jahren hat sich die orale Therapie mit Acalabrutinib inzwischen als in den Leitlinien empfohlener Standard in der Erst- und Zweitlinie bei CLL bewährt. Langzeitdaten bestätigen die in Studien und klinischer Versorgung beobachtete starke Bilanz des Zweitgenerations-BTKi.
Kernpunkte:
- Acalabrutinib zeigt noch nach Jahren eine anhaltende Wirksamkeit bei CLL.1
- Die Wirksamkeit ist risikounabhängig. Der Zweitgenerations-BTKi verlängert auch bei hohem genetischen Risiko das progressionsfreie Überleben signifikant.1,2
- Das Sicherheitsprofil von Acalabrutinib erweist sich über die Zeit als stabil. Viele anfängliche Nebenwirkungen lassen im Verlauf der Therapie nach.1
Weniger Nebenwirkungen dank höherer Selektivität
Die Hemmung der Bruton-Tyrosinkinase ist eine hochwirksame Strategie bei der Behandlung der Chronischen lymphatischen Leukämie. Mit Ibrutinib kam im Jahr 2014 der erste Vertreter dieser innovativen Wirkstoffklasse auf den Markt.
Die EMA-Zulassung für Acalabrutinib (Calquence®) im November 2020 war der Startschuss für die zweite Generation der Bruton-Tyrosinkinase-Inhibitoren. Seither steht ein Inhibitor der Bruton-Tyrosinkinase mit noch größerer Selektivität zur Verfügung, der gegenüber seinem Vorgänger Ibrutinib eine verringerte Toxizität bei vergleichbarer Wirksamkeit aufweist.3
Die zulassungsrelevanten Phase-III-Studien ELEVATE TN (therapienaive CLL) und ASCEND (rezidivierte/refraktäre CLL) verhalfen Acalabrutinib zum Durchbruch.4,5 Schon hier zeigte sich die deutliche Überlegenheit des Zweitgenerations-BTKi im Sicherheitsprofil gegenüber einer Chemoimmuntherapie. In der Phase-III-Studie ELEVATE RR wurde die Nichtunterlegenheit von Acalabrutinib gegenüber Ibrutinib hinsichtlich des progressionsfreien Überlebens (primärer Endpunkt) bestätigt.3 Gleichzeitig wies der neue BTKi eine günstigere Verträglichkeit auf.3
Acalabrutinib als Mono- und Kombinationstherapie überlegen
Im 4- und 5-Jahres-Follow-up von ELEVATE TN legte Acalabrutinib nochmals nach. Beim letzten Jahreskongress der American Society of Clinical Onkologie (ASCO) im Jahr 2022 wurden die Daten vorgestellt.6 Es zeigte sich:
- Calquence® ist auch nach 60 Monaten langanhaltend wirksam.
- Calquence® wirkt über alle relevanten Subgruppen hinweg unabhängig von genetischen Risikofaktoren.
Verglichen wurde Acalabrutinib (in Kombination mit dem CD20-Antikörper Obinutuzumab: A + O sowie als Monotherapie: A) im 4- bzw. 5-Jahres-Follow-up mit einer Chemoimmuntherapie (Obinutuzumab + Chlorambucil, O + Clb). Primärer Endpunkt war das progressionsfreie Überleben (progression-free survival, PFS). Weitere Endpunkte waren Gesamtüberleben (overall survival, OS) und Sicherheit.
Klarer PFS-Vorteil unter Acalabrutinib nach 5 Jahren
Die 5-Jahres-Daten bei therapienaiven Patientinnen und Patienten bestätigten dem Zweitgenerations-BTKi mit geschätzten 60-Monate-PFS-Raten von 84 % (A + O) bzw. 72 % (A) ein signifikant längeres progressionsfreies Überleben im Vergleich zur Chemoimmuntherapie (21 %):1
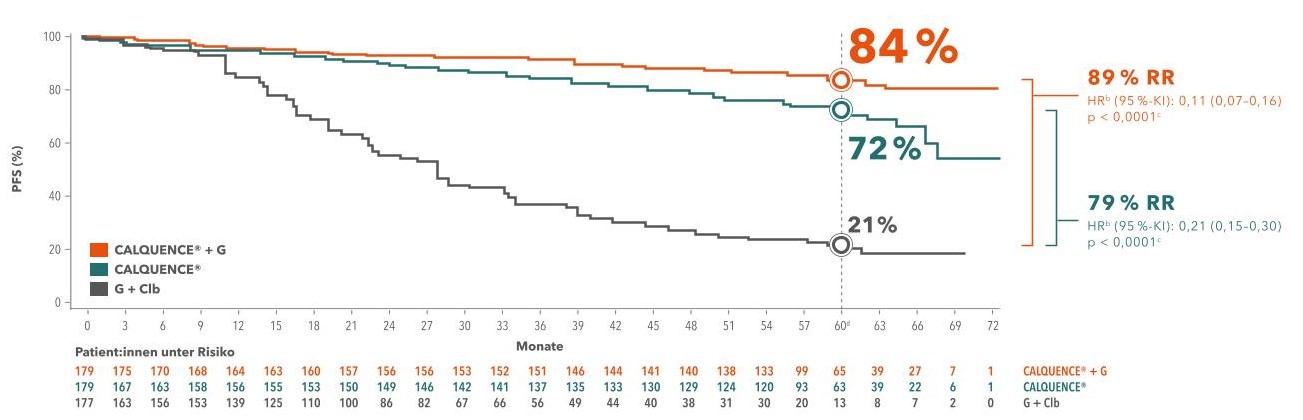
Abbildung 1: Progressionsfreies Überleben unter A, A + O und O + Clb. Adaptiert nach Sharman JP et al., 2022.1
„Acalabrutinib demonstriert eine dauerhafte Krankheitskontrolle, Tolerabilität und Flexibilität bei therapienaiven CLL-Patienten, unabhängig davon, ob die Behandlung als Mono- oder Kombinationstherapie erfolgt“, so das Fazit von Dr. Jeff Sharman, Forschungsdirektor am Willamette Valley Cancer Institute (Eugene, Oregon, USA) beim ASCO 2022.7
Wirksamkeit auch bei intermediärem und Hochrisiko
Im Follow-up wurde zudem das PFS mit und ohne genetische Risikofaktoren untersucht. Als genetisch ungünstig gelten eine 17p-Deletion bzw. TP53-Mutation sowie ein unmutierter IGHV-Status (IGHVunmut).8 Vor allem bei unmutiertem IGHV erwiesen sich beide Acalabrutinib-Arme (A, A + O) als klar überlegen gegenüber O + Clb:
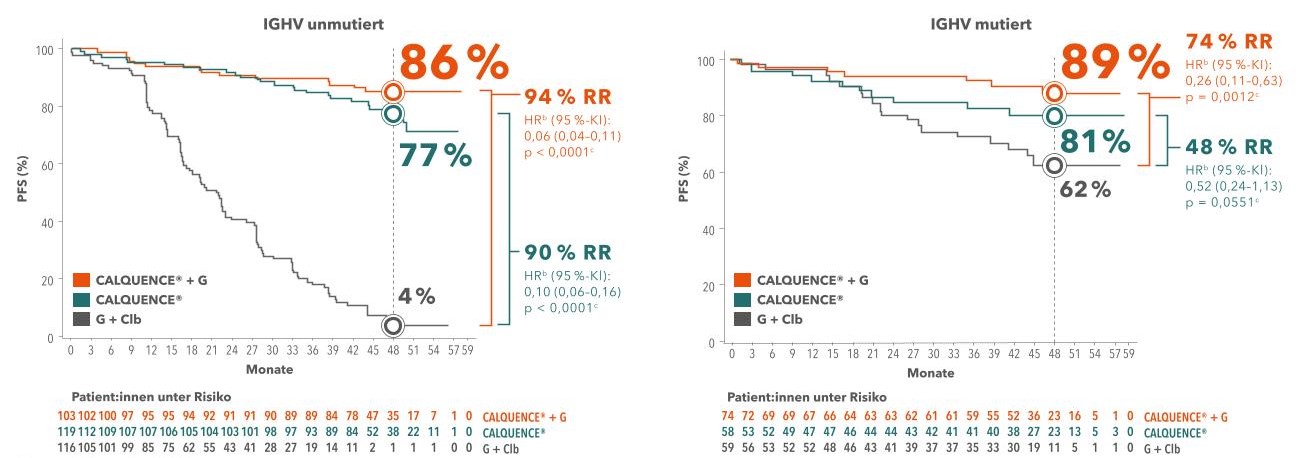
Abbildung 2: Progressionsfreies Überleben unter A, A + O und O + Clb bei unmutiertem und mutiertem IGHV-Status. Adaptiert nach Sharman JP et al., 2022.2
Weitere Ergebnisse der ELEVATE-TN nach 5 Jahren:1
- medianes PFS unter A + O gegenüber Chemoimmuntherapie: N.E. vs. 27,8 Monate (HR 0,11; 95 % CI: 0,07–0,16); p< 0,0001)
- starke PFS-Raten auch bei Hochrisiko-CLL mit 17p-Deletion/TP53-Mutation (71 % unter A bzw. A + O vs. 18 % unter Chemoimmuntherapie)
- Gesamtansprechrate (ORR) unter A+O: 96,1% (95% KI: 92,2; 98,1; p<0,0001), A: 89,9% (95% KI: 84,7; 93,5; p=0,0499)
- signifikant längeres medianes Gesamtüberleben (OS) mit A + O vs. O + Clb (HR 0,55; 95 % CI: 0,30–0,99; p = 0,0474)
- geschätzte 60-Monate-OS-Raten: 90% (A+O), 84% (A), 82% (Clb+O)
- mit früheren Analysen konsistente Sicherheitsprofile unter A + O und A
Wenig Nebenwirkungen, geringe Therapieabbruchraten
Häufigste Nebenwirkungen unter A bzw. A + O waren Diarrhoe, Kopfschmerzen, Neutropenie und Fatigue. Dies deckt sich mit Beobachtungen aus der Primäranalyse von ELEVATE-TN.4 Allerdings lassen die meisten Nebenwirkungen, die im ersten Therapiejahr häufig auftreten, im Lauf der Zeit nach. Die kumulative Inzidenz von kardiovaskulären Risiken wie Vorhofflimmern und Hypertonie blieb über die Jahre auf niedrigem Niveau stabil .2
Das insgesamt moderate Nebenwirkungsprofil spiegelt sich auch in einer hohen Therapiekontinuität.2 Das insgesamt moderate Nebenwirkungsprofil spiegelt sich auch in einer hohen Therapiekontinuität.2 Die Therapieabbruchraten in den Acalabrutinibarmen (AO: 17,3%; A: 15,6%) entsprachen annährend denen im Arm mit Clb+O (14,1%)
Für Dr. Versha Banerji vom CancerCare Manitoba Research Institute (University of Manitoba, Kanada), ist damit klar, was die derzeit beste Behandlungsoption für CLL-Patienten mit hohem Risiko ist: „Wir haben mit Acalabrutinib eine sichere und tolerierbare Behandlung für High-Risk-Patienten, die besser ist als die bisherige Standardbehandlung“, resumierte die Expertin beim ASCO 2022.9 Und gab zugleich einen Ausblick auf die zukünftige Forschung im Bereich der CLL-Therapie: „Wir haben noch eine Menge zu lernen und können uns bei der Versorgung von Patienten mit CLL auf eine großartige Zukunft freuen.“9
Calquence® 100 mg Filmtabletten/Calquence® 100 mg Hartkapseln
▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden.
Wirkstoff: Acalabrutinib. Verschreibungspflichtig. Zusammensetzung: Calquence 100 mg Filmtabletten: Jede Filmtablette enthält 100 mg Acalabrutinib (als Acalabrutinibmaleat). Calquence 100 mg Hartkapseln: Jede Hartkapsel enthält 100 mg Acalabrutinib. Sonstige Bestandteile: Calquence 100 mg Filmtabletten: Tablettenkern: Mannitol (Ph.Eur.) (E421), Mikrokristalline Cellulose (E460), niedrig substituierte Hydroxypropylcellulose (E463), Natriumstearylfumarat (Ph.Eur.); Filmüberzug: Hypromellose (E464), Copovidon, Titandioxid (E171), Macrogol (3350), mittelkettige Triglyceride, Eisen(III)-hydroxid-oxid x H2O (E172), Eisen(III)-hydroxid-oxid x H2O (E172). Calquence 100 mg Hartkapseln: Kapselinhalt: Mikrokristalline Cellulose (E460), hochdisperses Siliciumdioxid, vorverkleisterte Stärke (Mais), Magnesiumstearat (E470b), Poly(O-carboxymethyl)stärke-Natriumsalz; Kapselhülle: Gelatine, Titandioxid (E171), Eisen(III)-hydroxid-oxid x H2O (E172), Indigocarmin (E132); Drucktinte: Schellack, Eisen(II,III)-oxid (E172), Propylenglycol (E1520), Ammoniak-Lösung. Anwendungsgebiete: Calquence als Monotherapie oder in Kombination mit Obinutuzumab ist zur Behandlung von erwachsenen Patienten mit nicht vorbehandelter chronischer lymphatischer Leukämie (CLL) indiziert. Calquence als Monotherapie ist zur Behandlung von erwachsenen Patienten mit chronischer lymphatischer Leukämie (CLL) indiziert, die mindestens eine Vorbehandlung erhalten haben. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile. Nebenwirkungen: Monotherapie: Sehr häufig: Infektion der oberen Atemwege, Sinusitis, sekundäre Primärtumoren, Neutropenie, Anämie, Kopfschmerzen, Schwindel, Hämatom, Prellungen, Petechien, Hämorrhagie/Hämatom, Diarrhoe, Übelkeit, Verstopfung, Erbrechen, Abdominalschmerzen, Hautausschlag, muskuloskelettale Schmerzen, Arthralgie, Fatigue, Hämoglobin verringert, absolute Neutrophilenzahl verringert, Thrombozyten verringert. Häufig: Pneumonie, Harnwegsinfektion, Nasopharyngitis, Bronchitis, Herpes-Virus-Infektionen, nichtmelanozytärer Hautkrebs, sekundäre Primärtumoren (ohne nichtmelanozytären Hautkrebs), Thrombozytopenie, Vorhofflimmern/-flattern, Ekchymose, gastrointestinale Blutung, intrakranielle Blutung, Hypertonie, Epistaxis, Asthenie. Gelegentlich: Aspergillus-Infektionen, Hepatitis-B-Reaktivierung, Lymphozytose, Tumorlyse-Syndrom. Kombinationstherapie: Sehr häufig: Infektion der oberen Atemwege, Sinusitis, Nasopharyngitis, Harnwegsinfektion, Pneumonie, sekundäre Primärtumoren, Neutropenie, Thrombozytopenie, Anämie, Kopfschmerzen, Schwindel, Hämatom, Prellungen, Petechien, Hämorrhagie/Hämatom, Hypertonie, Diarrhoe, Übelkeit, Verstopfung, Erbrechen, Abdominalschmerzen, Hautausschlag, muskuloskelettale Schmerzen, Arthralgie, Fatigue, absolute Neutrophilenzahl verringert, Thrombozyten verringert, Hämoglobin verringert. Häufig: Bronchitis, Herpes-Virus-Infektionen, nichtmelanozytärer Hautkrebs, sekundäre Primärtumoren (ohne nichtmelanozytären Hautkrebs), Vorhofflimmern/-flattern, Ekchymose, gastrointestinale Blutung, Epistaxis, Asthenie. Gelegentlich: progressive multifokale Leukoenzephalopathie, Hepatitis-B-Reaktivierung, Lymphozytose, Tumorlyse-Syndrom, intrakranielle Blutung. Sehr selten: Aspergillus-Infektionen. Weitere Hinweise: siehe Fachinformationen. Pharmazeutischer Unternehmer: AstraZeneca GmbH, Friesenweg 26, 22763 Hamburg, E-Mail: azinfo@astrazeneca.com, www.astrazeneca.de, Servicehotline für Produktanfragen: 0800 22 88 660. Stand: August 2023.
DE-61418/2023
- Sharman JP et al. Acalabrutinib ± obinutuzumab versus obinutuzumab + chlorambucil in treatment-naïve chronic lymphocytic leukemia: Five-year follow-up of ELEVATE-TN. J Clin Oncol 2022;40:7539.
- Sharman JP et al. Efficacy and safety in a 4-year follow-up of the ELEVATE-TN study comparing acalabrutinib with or without obinutuzumab versus obinutuzumab plus chlorambucil in treatment-naïve chronic lymphocytic leukemia. Leukemia. 2022;36(4):1171–1175.
- Byrd JC, Hillmen P, Ghia P, et al. Acalabrutinib versus ibrutinib in previously treated chronic lymphocytic leukemia: results of the first randomized phase III trial. J Clin Oncol. 2021;39(31):3441–3452.
- Sharman JP et al. Acalabrutinib with or without obinutuzumab versus chlorambucil and obinutuzumab for treatment-naive chronic lymphocytic leukaemia (ELEVATE TN): a randomised, controlled, phase 3trial. Lancet 2020;395:1278-91.
- Ghia P et al. ASCEND: Phase III, Randomized Trial of Acalabrutinib Versus Idelalisib Plus Rituximab or Bendamustine Plus Rituximab in Relapsed or Refractory Chronic Lymphocytic Leukemia. J Clin Oncol 2020;38(25):2849-61.
- Sharman JP et al, 2022. Präsentiert auf: American Society of Clinical Oncology (ASCO) Annual Meeting; 3.–7. Juni 2022, Chicago, Illinois.
- ELEVATE-TN: At 5 Years, Progression-free Survival with High Tolerability Maintained in Treatment-naïve CLL Patients. American Society of Clinical Oncology (ASCO) 2022 Annual Meeting. June 3-7, 2022 / Chicago, Illinois. themedicalxchange.com
- Wendtner CM et al. Onkopedia-Leitlinie Chronische Lymphatische Leukämie (CLL). Stand: Januar 2023.
- Continued Benefit for First-line CLL Treatment: ELEVATE-TN 5-year Follow-up. American Society of Clinical Oncology (ASCO) 2022 Annual Meeting. June 3-7, 2022 / Chicago, Illinois. Interview online unter: https://themedicalxchange.com/eLearning/8077/hematology/oncology/CLL#en/media/1954 (letzter Aufruf: Mai 2023).
Abkürzungen:
BTK = Bruton-Tyrosinkinase
BTKi = Bruton-Tyrosinkinase-Inhibitor
CLL = Chronische lymphatische Leukämie
CYP = Cytochrom P
EGF = Epidermal Growth Factor EGF
PFS = progressionsfreies Überleben
DE-60017/23

