Acalabrutinib im Sicherheitscheck: Wie verträglich ist der BTKi der zweiten Generation?
Der BTK-Inhibitor Acalabrutinib zeichnet sich durch eine hohe Selektivität im Bindungsverhalten aus. Doch wie macht sich dieser Effekt im Therapiealltag bei Betroffenen mit CLL bemerkbar? Treten tatsächlich weniger Nebenwirkungen auf? Und wie ist es um die Therapieadhärenz bestellt? Antworten auf diese Fragen finden Sie im folgenden Beitrag.
Kernpunkte:
- Acalabrutinib ist der selektivste der aktuell zugelassenen kovalenten BTKi.1
- Durch die hohe Selektivität treten weniger Off-Target-Effekte auf.1,2
- Im direkten Head-to-Head-Vergleich mit Ibrutinib zeigt Acalabrutinib weniger Nebenwirkungen bei vergleichbarer Wirksamkeit.3
- Dank der guten Verträglichkeit wird die Therapie mit Calquence® seltener abgebrochen.4
Mit der Markteinführung von Acalabrutinib im November 2020 war die Hoffnung auf eine zielgenauere, besser verträgliche Therapie der CLL verbunden. Die Hemmung der Bruton-Tyrosinkinase ist als Therapieprinzip schon seit fast zehn Jahren etabliert. Mit Ibrutinib kam im Jahr 2014 der erste Vertreter dieser Wirkstoffklasse auf den Markt, was einen bedeutenden therapeutischen Fortschritt brachte. Doch bestimmte mit Ibrutinib in Zusammenhang stehende Nebenwirkungen führten bei einigen Patient:innen zum vorzeitigen Therapieabbruch.5 Hierdurch kann ein weiteres Fortschreiten der Erkrankung begünstigt werden.6
Unerwünschte Nebenwirkungen durch Off-Target-Effekte
Die Bruton-Tyrosinkinase ist ein Schlüsselenzym in der Pathogenese der CLL. Sie nimmt eine wichtige Funktion in der Signaltransduktion von B-Zellen ein und ist maßgeblich an deren Proliferation beteiligt.2 Der antineoplastische Effekt der BTK-Inhibitoren beruht auf der irreversiblen Hemmung der enzymatischen Aktivität. Dadurch wird die Signalkaskade unterbrochen und das überschießende Zellwachstum verhindert.2
Doch im Bindungsverhalten der einzelnen Substanzen gibt es entscheidende Unterschiede. So können neben der anvisierten BTK zahlreiche weitere Kinasen gehemmt werden. Einige davon werden mit bestimmten immunologischen, kardiovaskulären und dermatologischen Nebenwirkungen in Verbindung gebracht.7-9 Diese sogenannten Off-Target-Effekte beruhen u.a. auf der Aktivierung von T-Zellen, natürlichen Killerzellen sowie des EGF-Rezeptors von Epidermalzellen.
Ziel bei der Weiterentwicklung der BTKi war daher, die Wirkweise so zu präzisieren, dass die Behandlung besser vertragen wird. Tatsächlich hemmen Acalabrutinib und sein aktiver Metabolit ACP-5862 andere Kinasen in geringerem Maße als die BTK-Inhibitoren Ibrutinib und Zanubrutinib und führen somit zu weniger Off-Target-Effekten.1,2 Durch die höhere Selektivität erhofft man sich in der Praxis weniger Nebenwirkungen.
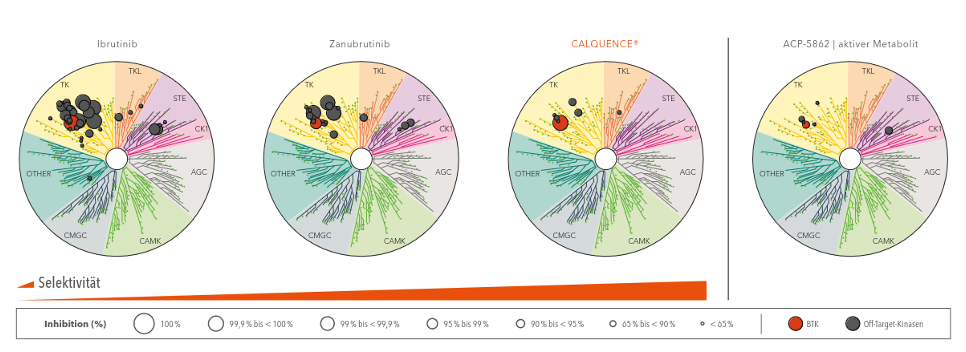
Abbildung 1: Vergleich von Acalabrutinib (Calquence®), ACP-5862, Ibrutinib und Zanubrutinib im kompetitiven Bindungsverhalten gegenüber verschiedenen Kinasen. Die roten Kreise symbolisieren die gewünschte BTK-Hemmung. In grau erscheinen unerwünschte Off-Target-Effekte an anderen Kinasen.1
Zur Vertiefung: Acalabrutinib und sein aktiver Metabolit1
ACP-5862 ist ein pharmakologisch bedeutsamer Metabolit, der durch CYP3A-Oxidation von Acalabrutinib entsteht. Es handelt sich um ein Amid mit oxidativ geöffnetem Pyrrolidinring. ACP-5862 bindet ebenso wie die Ausgangssubstanz an den Cystein-Rest im aktiven Zentrum der BTK und entfaltet darüber seine Wirkung.
In vitro wurde eine vergleichbare Selektivität und Affinität zur BTK gefunden. Für die Effektivität und Sicherheit von Calquence® könnte ACP-5862 damit eine ähnliche große Bedeutung wie Acalabrutinib selbst haben.
Zugleich erwiesen sich Acalabrutinib und sein aktiver Metabolit als selektiver im Vergleich zu den BTK-Inhibitoren Ibrutinib und Zanubrutinib. Dazu wurde bei einer bestimmten Konzentration in vitro getestet, wie viele andere Kinasen durch die Substanzen jeweils gehemmt werden. Die Trefferquote von Acalabrutinib ACP-5862 war dabei geringer als die der anderen BTKi.
Doch machen sich diese pharmakologischen Unterschiede auch in vivo bemerkbar? In ELEVATE RR, einer randomisierten Phase-III-Studie an Patientinnen und Patienten mit refraktärer CLL bzw. Rezidiv wurde Acalabrutinib einem direkten Vergleich mit seinem Vorgänger Ibrutinib unterzogen.3 Im primären Endpunkt PFS (progressionsfreies Überleben) waren die Substanzen vergleichbar. Das mediane PFS betrug in beiden Therapiearmen 38,4 Monate (Acalabrutinib: 95% CI, 33.0-38.6; Ibrutinib: 95% CI, 33.0-41.6; HR 1.00; 95% CI, 0.79-1.27).3
Wirksamkeit: Acalabrutinib nicht unterlegen
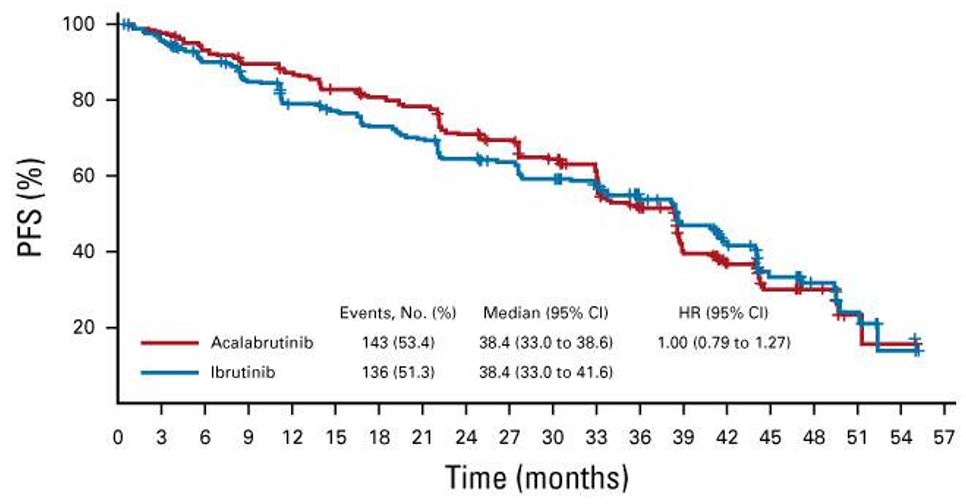
Abbildung 2: Kaplan-Meier-Kurve des progressionsfreien Überlebens (PFS). Acalabrutinib und Ibrutinib im Vergleich.3
Acalabrutinib versus Ibrutinib: Nebenwirkungen machen den Unterschied
Bei der Verträglichkeit zeigten sich hingegen deutliche Unterschiede. Zahlreiche Nebenwirkungen wie Diarrhoe, Arthralgien, Rückenschmerzen und Muskelspasmen traten unter Acalabrutinib seltener auf.3 Kopfschmerzen und Husten waren hingegen bei Acalabrutinib häufiger als bei seinem Vorgänger.3
Auch bei kardiovaskulären Nebenwirkungen zeigte der BTKi der zweiten Generation Vorteile. Vorhofflimmern ist ein Nebeneffekt der Behandlung, der die Mortalität bei CLL-Patienten erhöht. Das Therapiemanagement ist aufgrund der erhöhten Blutungsgefahr und der medikamentösen Interaktion mit Antikoagulantien anspruchsvoll. Eine retrospektive Kohortenstudie zeigte, dass Vorhofflimmern unter Ibrutinib der häufigste Grund für einen Therapieabbruch ist.10
Die Inzidenz von Vorhofflimmern war mit 9,4 % unter dem Zweitgenerations-BTKi signifikant niedriger als unter Ibrutinib (16 %); die kumulative Ereignisrate war um 48 % geringer.3 Unter Acalabrutinib brach keiner der Probanden die Behandlung aufgrund von Vorhofflimmern ab, während es bei Ibrutinib knapp 17 % waren.3
Ähnliche Ergebnisse zeigten sich beim Bluthochdruck, der unter Acalabrutinib signifikant seltener auftrat als unter seinem Vorgänger (9,4 % versus 23,3 %).3 Ein direkter Vergleich zwischen Acalabrutinib und Zanubrutinib wurde bislang nicht angestellt. In einer indirekten Vergleichsanalyse war jedoch das Risiko für eine Hypertonie (jeglichen Grades sowie speziell Grad ≥ 3) unter Acalabutinib ebenfalls geringer.11
Sicherheit: weniger Vorhofflimmern und Hypertonie unter Acalabrutinib
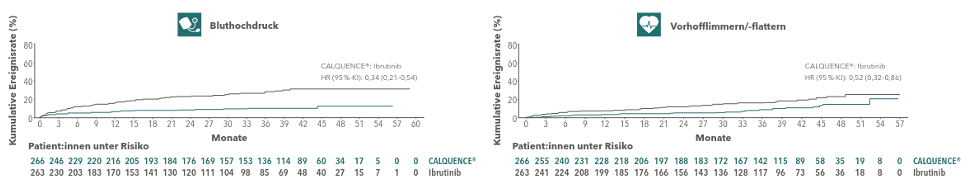
Abbildung 3: Kumulative Ereignisrate von Bluthochdruck und Vorhofflimmern. Acalabrutinib und Ibrutinib im Vergleich.3
Längere Therapiezeit, weniger Therapieabbrüche
Und in der Real World? In einer retrospektiven Kohortenstudie, in der die Daten von mehr als 2500 Probanden über einen Zeitraum von drei Jahren analysiert wurden, bestätigte sich die Überlegenheit von Acalabrutinib im Head-to-Head-Vergleich mit Ibrutinib.4
Es zeigte sich: Die Rate an Therapieabbrüchen nach 12 Monaten war unter dem neuen BTKi geringer (Acalabrutinib: 22 %, Ibrutinib: 31 %, p = 0,005), die Zeit bis zur Therapieunterbrechung länger.4 Wurden vorangegangene Behandlungen berücksichtigt, war das Risiko für einen Therapieabbruch unter Acalabrutinib um 41 % geringer als unter Ibrutinib (HR=0.59; 95%
CI: 0.43-0.81; p = 0,001).4
Die Behandlung mit BTK-Inhibitoren ist eine Dauertherapie. Daher sind Verträglichkeit und Adhärenz entscheidend für den Therapieerfolg. Die neuesten Daten bescheinigen dem Zweitgenerations-BTKi Acalabrutinib einen relevanten Vorteil hinsichtlich Sicherheit und Verträglichkeit gegenüber der ersten Generation. Stetige Verbesserungen wie zuletzt die Entwicklung von Calquence®-Tabletten können die Patientenzufriedenheit und Compliance in Zukunft weiter steigern.
Calquence® 100 mg Filmtabletten/Calquence® 100 mg Hartkapseln
▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden.
Wirkstoff: Acalabrutinib. Verschreibungspflichtig. Zusammensetzung: Calquence 100 mg Filmtabletten: Jede Filmtablette enthält 100 mg Acalabrutinib (als Acalabrutinibmaleat). Calquence 100 mg Hartkapseln: Jede Hartkapsel enthält 100 mg Acalabrutinib. Sonstige Bestandteile: Calquence 100 mg Filmtabletten: Tablettenkern: Mannitol (Ph.Eur.) (E421), Mikrokristalline Cellulose (E460), niedrig substituierte Hydroxypropylcellulose (E463), Natriumstearylfumarat (Ph.Eur.); Filmüberzug: Hypromellose (E464), Copovidon, Titandioxid (E171), Macrogol (3350), mittelkettige Triglyceride, Eisen(III)-hydroxid-oxid x H2O (E172), Eisen(III)-hydroxid-oxid x H2O (E172). Calquence 100 mg Hartkapseln: Kapselinhalt: Mikrokristalline Cellulose (E460), hochdisperses Siliciumdioxid, vorverkleisterte Stärke (Mais), Magnesiumstearat (E470b), Poly(O-carboxymethyl)stärke-Natriumsalz; Kapselhülle: Gelatine, Titandioxid (E171), Eisen(III)-hydroxid-oxid x H2O (E172), Indigocarmin (E132); Drucktinte: Schellack, Eisen(II,III)-oxid (E172), Propylenglycol (E1520), Ammoniak-Lösung. Anwendungsgebiete: Calquence als Monotherapie oder in Kombination mit Obinutuzumab ist zur Behandlung von erwachsenen Patienten mit nicht vorbehandelter chronischer lymphatischer Leukämie (CLL) indiziert. Calquence als Monotherapie ist zur Behandlung von erwachsenen Patienten mit chronischer lymphatischer Leukämie (CLL) indiziert, die mindestens eine Vorbehandlung erhalten haben. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile. Nebenwirkungen: Monotherapie: Sehr häufig: Infektion der oberen Atemwege, Sinusitis, sekundäre Primärtumoren, Neutropenie, Anämie, Kopfschmerzen, Schwindel, Hämatom, Prellungen, Petechien, Hämorrhagie/Hämatom, Diarrhoe, Übelkeit, Verstopfung, Erbrechen, Abdominalschmerzen, Hautausschlag, muskuloskelettale Schmerzen, Arthralgie, Fatigue, Hämoglobin verringert, absolute Neutrophilenzahl verringert, Thrombozyten verringert. Häufig: Pneumonie, Harnwegsinfektion, Nasopharyngitis, Bronchitis, Herpes-Virus-Infektionen, nichtmelanozytärer Hautkrebs, sekundäre Primärtumoren (ohne nichtmelanozytären Hautkrebs), Thrombozytopenie, Vorhofflimmern/-flattern, Ekchymose, gastrointestinale Blutung, intrakranielle Blutung, Hypertonie, Epistaxis, Asthenie. Gelegentlich: Aspergillus-Infektionen, Hepatitis-B-Reaktivierung, Lymphozytose, Tumorlyse-Syndrom. Kombinationstherapie: Sehr häufig: Infektion der oberen Atemwege, Sinusitis, Nasopharyngitis, Harnwegsinfektion, Pneumonie, sekundäre Primärtumoren, Neutropenie, Thrombozytopenie, Anämie, Kopfschmerzen, Schwindel, Hämatom, Prellungen, Petechien, Hämorrhagie/Hämatom, Hypertonie, Diarrhoe, Übelkeit, Verstopfung, Erbrechen, Abdominalschmerzen, Hautausschlag, muskuloskelettale Schmerzen, Arthralgie, Fatigue, absolute Neutrophilenzahl verringert, Thrombozyten verringert, Hämoglobin verringert. Häufig: Bronchitis, Herpes-Virus-Infektionen, nichtmelanozytärer Hautkrebs, sekundäre Primärtumoren (ohne nichtmelanozytären Hautkrebs), Vorhofflimmern/-flattern, Ekchymose, gastrointestinale Blutung, Epistaxis, Asthenie. Gelegentlich: progressive multifokale Leukoenzephalopathie, Hepatitis-B-Reaktivierung, Lymphozytose, Tumorlyse-Syndrom, intrakranielle Blutung. Sehr selten: Aspergillus-Infektionen. Weitere Hinweise: siehe Fachinformationen. Pharmazeutischer Unternehmer: AstraZeneca GmbH, Friesenweg 26, 22763 Hamburg, E-Mail: azinfo@astrazeneca.com, www.astrazeneca.de, Servicehotline für Produktanfragen: 0800 22 88 660. Stand: August 2023.
DE-61418/2023
- Podoll T et al. Identification and Characterization of ACP-5862, the Major Circulating Active Metabolite of Acalabrutinib: Both Are Potent and Selective Covalent Bruton Tyrosine Kinase Inhibitors. J Pharmacol Exp Ther. 2023;384(1):173–186.
- Barf T et al. Acalabrutinib (ACP-196): A Covalent Bruton Tyrosine Kinase Inhibitor with a Differentiated Selectivity and In Vivo Potency Profile. J Pharmacol Exp Ther 2017;363:240-52.
- Byrd JC et al. Acalabrutinib Versus Ibrutinib in Previously Treated Chronic Lymphocytic Leukemia: Results of the First Randomized Phase III Trial. J Clin Oncol. 2021;39(31):3441–3452 und Supplement.
- Roeker LE et al. Comparing Acalabrutinib and Ibrutinib in the Real World: A Study of 2,509 Patients with Chronic Lymphocytic Leukemia. Blood. 2022;140 (Supplement 1):4156–4158.
- Hampel PJ et al. Rapid disease progression following discontinuation of ibrutinib in patients with chronic lymphocytic leukemia treated in routine clinical practice. Leuk Lymphoma 2019;60(11):2712-9.
- Mato AR et al. Toxicities and outcomes of 616 ibrutinib-treated patients in the United States: a real-world analysis. Haematologica 2018;103: 874-9.
- Kaptein A et al. Potency and Selectivity of BTK Inhibitors in Clinical Development for B-Cell Malignancies. Blood 2018;132(Suppl_):1871.
- Xiao L et al. Ibrutinib-Mediated Atrial Fibrillation Attributable to Inhibition of C-Terminal Src Kinase. Circulation 2020;142(25):2443-55.
- Estupiñán HY et al. Comparative Analysis of BTK Inhibitors and Mechanisms Underlying Adverse Effects. Front Cell Dev Biol;2021;9:630942.
- Mato AR, Nabhan C, Barr PM, et al.: Outcomes of CLL patients treated with sequential kinase inhibitor therapy: A real world experience. Blood 128:2199-2205, 2016.
- Kittai AS, et al. A matching-adjusted indirect comparison (MAIC) of the efficacy and safety of acalabrutinib (acala) versus zanubrutinib (zanu) in relapsed or refractory chronic lymphocytic leukemia (RR CLL). Präsentiert auf European Hematology Association (EHA) Hybrid Kongress; 08.–11. Juni 2023.
Abkürzungen:
BTK = Bruton-Tyrosinkinase
BTKi = Bruton-Tyrosinkinase-Inhibitor
CLL = Chronische lymphatische Leukämie
CYP = Cytochrom P
EGF = Epidermal Growth Factor EGF
PFS = progressionsfreies Überleben
DE-60017/23


