Gleiche Wirkstärke, vereinfachte Einnahme
Seit dem 15. März 2023 ist der BTK-Inhibitor Acalabrutinib (Calquence<sup>®</sup>) als Filmtablette erhältlich. Für Betroffene mit CLL wird die Einnahme dadurch einfacher.
Kernpunkte:
- Calquence® 100 mg-Filmtabletten werden wie die Hartkapseln zweimal täglich im Abstand von 12 Stunden unabhängig von den Mahlzeiten eingenommen.1
- Die Filmtabletten sind bioäquivalent in Wirksamkeit und Verträglichkeit.1
- Eine gleichzeitige Anwendung von Magensäure-reduzierenden Wirkstoffen wie Protonenpumpen-Inhibitoren, Antazida oder H2-Rezeptor-Antagonisten ist möglich.1
Im November 2020 wurde mit Acalabrutinib die zweite Generation der Bruton-Tyrosinkinase-Inhibitoren (BTKi) zur Behandlung der chronischen lymphatischen Leukämie zugelassen. Inzwischen ist der Wirkstoff fester Bestandteil sowohl in der Erstlinien- als auch in der Zweitlinientherapie. In der jüngst aktualisierten Onkopedia-Leitlinie rangiert er mit an erster Stelle.2
Mehr Sicherheit: von der ersten zur zweiten BTKi-Generation3
Mit Ibrutinib, dem ersten Vertreter der BTKi, kam ein gänzlich neues Wirkprinzip zum Portfolio der CLL-Behandlung hinzu, das darüber hinaus erstmals eine vollständig orale Therapie erlaubte. Die Bruton-Tyrosinkinase ist ein Enzym, das eine wichtige Rolle bei der Signaltransduktion von B-Lymphozyten und anderen Zellen spielt. Sie trägt maßgeblich zur Migration und Proliferation der entarteten B-Zellen bei der CLL bei.3 Hemmstoffe der BTK binden kovalent an das aktive Zentrum der Kinase und führen so zu einer anhaltenden Hemmung der enzymatischen Aktivität.3
Im Vergleich zum Vorgänger Ibrutinib wurden Wirk- und Sicherheitsprofil in der zweiten BTKi-Generation verbessert. Mit seinem hochselektiven Bindungsverhalten hat Acalabrutinib weit weniger unspezifische Wirkungen auf andere Enzyme und ist dadurch besser verträglich als sein Vorgänger.4 So waren in den Zulassungsstudien ELEVATE-TN und ASCEND insbesondere kardiovaskuläre Nebenwirkungen wie Vorhofflimmern und Hypertonie unter Acalabrutinib seltener zu beobachten als unter Ibrutinib.5,6 Seither hat sich der neue BTK-Inhibitor in der klinischen Praxis weiter bewährt und im direkten Vergleich mit der ersten Generation behauptet.7
Mehr Komfort: von der Kapsel zur Tablette
Ein klarer Vorteil der neuen Wirkstoffklasse aus Patientensicht liegt in der oralen Applikation. Die einfache, unkomplizierte Einnahme ohne zeitaufwendige Klinikaufenthalte und engmaschige Kontrollen fördert die Lebensqualität und trägt maßgeblich zur Patientenzufriedenheit bei. Davon zeugen Erfahrungswerte aus dem klinischen Alltag.8
Mit dem Ersatz der Hartkapseln durch die Filmtabletten wird die Einnahme nun nochmals erleichtert. Die 7,5 x 13 mm große, ovale 100mg-Tablette ist deutlich filigraner als die Kapsel, was die Einnahme erleichtert, auch für Patienten mit Schluckproblemen. Sie wird wie die Kapsel zweimal täglich unabhängig von den Mahlzeiten eingenommen. Bilder auf dem Blisterstreifen (Sonne für morgens, Mond für abends) geben Orientierung und helfen, die Dosis zum richtigen Zeitpunkt einzunehmen.9
 Abbildung 1: Die Einnahme der neuen Filmtabletten unterscheidet sich nicht von den bisherigen Kapseln.1
Abbildung 1: Die Einnahme der neuen Filmtabletten unterscheidet sich nicht von den bisherigen Kapseln.1
Mehr Spielraum: unkomplizierte Kombination mit PPI
Auch im Therapiemanagement lässt sich die neue Formulierung besser händeln. So können Calquence® Filmtabletten problemlos zusammen mit Magensäure-reduzierenden Wirkstoffen wie Protonenpumpen-Inhibitoren, Antazida oder H2-Rezeptor-Antagonisten eingenommen werden. Bei den Kapseln mit ihrer pH-Wert abhängigen Wirksamkeit war diese Kombination nicht oder nur eingeschränkt möglich.10
Zur Vertiefung: Acalabrutinib, pH-Wert und PPI
Mit steigendem pH-Wert verringert sich die Löslichkeit von Acalabrutinib, die Bioverfügbarkeit sinkt dementsprechend. Das hat Auswirkungen auf die AUC (Area under the curve), den geometrischen Mittelwert der Fläche unter der Plasmakonzentrations-Zeit-Kurve als Maßstab für die Pharmakokinetik eines Arzneimittels.1 Eine Kombination mit dem Protonenpumpenhemmer (PPI) Omeprazol 40 mg für 5 Tage verringert die AUC (Area under the curve) von Acalabrutinib um 43 %.11
Die gleichzeitige Anwendung von Acalalabrutinib-Kapseln mit PPIs sollte daher vermieden werden. Bei H2-Rezeptor-Antagonisten und Antazida muss die Einnahme von Calquence® Hartkapseln zeitversetzt erfolgen.11
Mit der neuen Wirkstoffformel konnten diese pharmakokinetischen Hindernisse beseitigt werden. Die 100 mg-Filmtabletten enthalten Acalabrutinibmaleat, ein Salz des Acalabrutinibs, das bei höheren pH-Werten besser löslich und resorbierbar ist als die Acalabrutinib-Base, der wirksame Bestandteil der Calquence-Kapseln.1
Calquence® Tabletten im Praxistest: ELEVATE PLUS
In ELEVATE PLUS wurden die neuen Tabletten in einer Serie aus drei randomisierten Cross-over-Studien an gesunden Probanden evaluiert.12 Dabei wurden folgende Fragestellungen untersucht:
- Sind 100 mg Acalabrutinibmaleat-Tabletten (AMT) und 100 mg Acalabrutinib-Kapseln bioäquivalent?
- Welchen Effekt hat die Kombination des PPI Rabeprazol mit AMT?
- Welchen Einfluss hat die Einnahme fetthaltiger Lebensmittel auf die Resorption von AMT?
- Wie wirkt sich die Applikation als nasogastrale Suspension auf die Pharmakokinetik von AMT aus?
Anhand der Plasmakonzentration von Acalabrutinib und seinem aktiven Metaboliten ACP-5862 über die Zeit wurde die AUC in den verschiedenen Behandlungsgruppen ermittelt.
Pharmakokinetisches Profil von Acalabrutinib in Abhängigkeit verschiedener Einnahmemodalitäten:
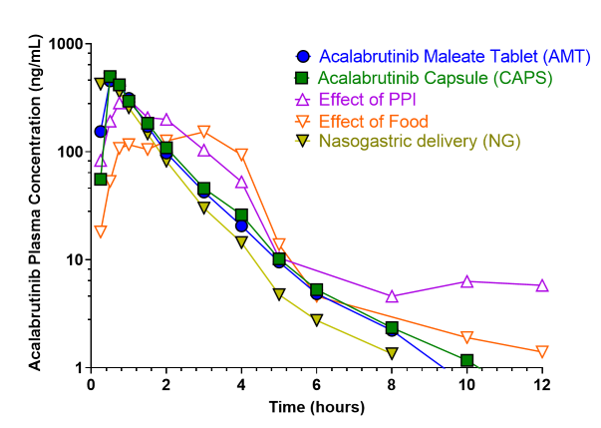
Abbildung 2: Plasmakonzentration von Acalabrutinib im zeitlichen Verlauf. Dargestellt sind die Plasmakonzentrations-Zeit-Kurven von Acalabrutinib Tabletten (AMT), Kapseln (CAPS), der Kombination aus Tabletten und PPI bzw. Nahrung sowie der Applikation als Suspension via nasogastrale Sonde (NG).12
Pharmakokinetisches Profil von ACP-5862 in Abhängigkeit verschiedener Einnahmemodalitäten:
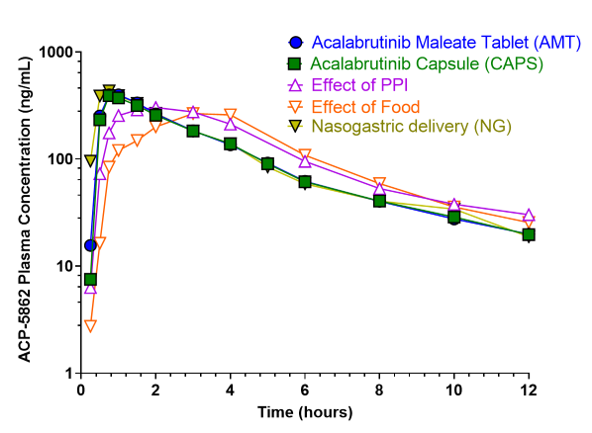
Abbildung 3: Plasmakonzentration von ACP-5862 im zeitlichen Verlauf. Dargestellt sind die Plasmakonzentrations-Zeit-Kurven von Acalabrutinib Tabletten (AMT), Kapseln (CAPS), der Kombination aus Tabletten und PPI bzw. Nahrung sowie der Applikation als Suspension via nasogastrale Sonde (NG).12
Pharmakokinetik von Kapseln und Tabletten vergleichbar
Zusammengefasst waren maximale Plasmakonzentration und AUC in beiden Formulierungen (Tabletten, Kapseln) nahezu identisch. Tabletten und Kapseln sind somit als bioäquivalent anzusehen.11,12 Die zusätzliche Einnahme von PPI führte zwar zu einer niedrigeren Maximalkonzentration von Acalabrutinib und seinem Metaboliten im Vergleich zur alleinigen Tabletteneinnahme. Im weiteren Verlauf nahm die Plasmakonzentration unter AMT + PPI jedoch weniger stark ab, so dass die AUC insgesamt größer war als unter AMT alleine.11,12
Einen ähnlichen Einfluss hatte auch die Aufnahme hochkalorischer Nahrungsmittel 30 Minuten vor Einnahme der Acalabrutinib-Maleat-Tabletten. Während die maximale Plasmakonzentration von Acalabrutinib und ACP-5862 auch hier niedriger ausfiel im Vergleich zur Einnahme auf nüchternen Magen, waren die AUCs jeweils vergleichbar.11,12
Schließlich zeigten sich auch bei der Applikationsform keine nennenswerten Unterschiede. Acalabrutinib-Maleat als Suspension in 15 ml Wasser, appliziert über eine nasogastrale Sonde, zeigte einen ähnlichen Verlauf der Plasmakonzentration wie die Einnahme von Kapseln.11,12
Kleine Veränderung, großer Gewinn
Wie die neuen Filmtabletten in der klinischen Praxis ankommen, wird sich in den nächsten Jahren zeigen. Klar ist bereits jetzt: Die Bioäquivalenz zu den Hartkapseln verspricht eine vergleichbare Wirksamkeit und Verträglichkeit bei gleichzeitig größerer Anwenderfreundlichkeit.11 Durch die Filmbeschichtung und ein um 50 % geringeres Volumen im Vergleich zu den Kapseln lassen sich die Tabletten deutlich leichter schlucken. Patientinnen und Patienten mit grundsätzlichen Schluckproblemen können den Wirkstoff auch als Suspension zu sich nehmen.11,12 Für viele Betroffene mit CLL kann die kleine Änderung am Gewand von Acalabrutinib ein großes Plus an Lebensqualität bringen.

Calquence® 100 mg Filmtabletten/Calquence® 100 mg Hartkapseln
▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden.
Wirkstoff: Acalabrutinib. Verschreibungspflichtig. Zusammensetzung: Calquence 100 mg Filmtabletten: Jede Filmtablette enthält 100 mg Acalabrutinib (als Acalabrutinibmaleat). Calquence 100 mg Hartkapseln: Jede Hartkapsel enthält 100 mg Acalabrutinib. Sonstige Bestandteile: Calquence 100 mg Filmtabletten: Tablettenkern: Mannitol (Ph.Eur.) (E421), Mikrokristalline Cellulose (E460), niedrig substituierte Hydroxypropylcellulose (E463), Natriumstearylfumarat (Ph.Eur.); Filmüberzug: Hypromellose (E464), Copovidon, Titandioxid (E171), Macrogol (3350), mittelkettige Triglyceride, Eisen(III)-hydroxid-oxid x H2O (E172), Eisen(III)-hydroxid-oxid x H2O (E172). Calquence 100 mg Hartkapseln: Kapselinhalt: Mikrokristalline Cellulose (E460), hochdisperses Siliciumdioxid, vorverkleisterte Stärke (Mais), Magnesiumstearat (E470b), Poly(O-carboxymethyl)stärke-Natriumsalz; Kapselhülle: Gelatine, Titandioxid (E171), Eisen(III)-hydroxid-oxid x H2O (E172), Indigocarmin (E132); Drucktinte: Schellack, Eisen(II,III)-oxid (E172), Propylenglycol (E1520), Ammoniak-Lösung. Anwendungsgebiete: Calquence als Monotherapie oder in Kombination mit Obinutuzumab ist zur Behandlung von erwachsenen Patienten mit nicht vorbehandelter chronischer lymphatischer Leukämie (CLL) indiziert. Calquence als Monotherapie ist zur Behandlung von erwachsenen Patienten mit chronischer lymphatischer Leukämie (CLL) indiziert, die mindestens eine Vorbehandlung erhalten haben. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile. Nebenwirkungen: Monotherapie: Sehr häufig: Infektion der oberen Atemwege, Sinusitis, sekundäre Primärtumoren, Neutropenie, Anämie, Kopfschmerzen, Schwindel, Hämatom, Prellungen, Petechien, Hämorrhagie/Hämatom, Diarrhoe, Übelkeit, Verstopfung, Erbrechen, Abdominalschmerzen, Hautausschlag, muskuloskelettale Schmerzen, Arthralgie, Fatigue, Hämoglobin verringert, absolute Neutrophilenzahl verringert, Thrombozyten verringert. Häufig: Pneumonie, Harnwegsinfektion, Nasopharyngitis, Bronchitis, Herpes-Virus-Infektionen, nichtmelanozytärer Hautkrebs, sekundäre Primärtumoren (ohne nichtmelanozytären Hautkrebs), Thrombozytopenie, Vorhofflimmern/-flattern, Ekchymose, gastrointestinale Blutung, intrakranielle Blutung, Hypertonie, Epistaxis, Asthenie. Gelegentlich: Aspergillus-Infektionen, Hepatitis-B-Reaktivierung, Lymphozytose, Tumorlyse-Syndrom. Kombinationstherapie: Sehr häufig: Infektion der oberen Atemwege, Sinusitis, Nasopharyngitis, Harnwegsinfektion, Pneumonie, sekundäre Primärtumoren, Neutropenie, Thrombozytopenie, Anämie, Kopfschmerzen, Schwindel, Hämatom, Prellungen, Petechien, Hämorrhagie/Hämatom, Hypertonie, Diarrhoe, Übelkeit, Verstopfung, Erbrechen, Abdominalschmerzen, Hautausschlag, muskuloskelettale Schmerzen, Arthralgie, Fatigue, absolute Neutrophilenzahl verringert, Thrombozyten verringert, Hämoglobin verringert. Häufig: Bronchitis, Herpes-Virus-Infektionen, nichtmelanozytärer Hautkrebs, sekundäre Primärtumoren (ohne nichtmelanozytären Hautkrebs), Vorhofflimmern/-flattern, Ekchymose, gastrointestinale Blutung, Epistaxis, Asthenie. Gelegentlich: progressive multifokale Leukoenzephalopathie, Hepatitis-B-Reaktivierung, Lymphozytose, Tumorlyse-Syndrom, intrakranielle Blutung. Sehr selten: Aspergillus-Infektionen. Weitere Hinweise: siehe Fachinformationen. Pharmazeutischer Unternehmer: AstraZeneca GmbH, Friesenweg 26, 22763 Hamburg, E-Mail: azinfo@astrazeneca.com, www.astrazeneca.de, Servicehotline für Produktanfragen: 0800 22 88 660. Stand: August 2023.
DE-61418/2023
- Fachinformation Calquence® 100 mg Filmtabletten, Stand: Februar 2023.
- Wendtner CM et al. Onkopedia-Leitlinie Chronische Lymphatische Leukämie (CLL). Stand: Januar 2023.
- Barf T et al. Acalabrutinib (ACP-196): A Covalent Bruton Tyrosine Kinase Inhibitor with a Differentiated Selectivity and In Vivo Potency Profile. J Pharmacol Exp Ther 2017;363:240-52.
- Herman SEM et al. The Bruton’s tyrosine kinase (BTK) inhibitor acalabrutinib demonstrates potent on-target effects and efficacy in two mouse models of chronic lymphocytic leukemia. Clin Cancer Res 2017;23(11):2831-41.
- Sharman JP et al. Acalabrutinib with or without obinutuzumab versus chlorambucil and obinutuzumab for treatment-naive chronic lymphocytic leukaemia (ELEVATE TN): a randomised, controlled, phase 3trial. Lancet 2020;395:1278-91.
- Ghia P et al. ASCEND: Phase III, Randomized Trial of Acalabrutinib Versus Idelalisib Plus Rituximab or Bendamustine Plus Rituximab in Relapsed or Refractory Chronic Lymphocytic Leukemia. J Clin Oncol 2020;38(25):2849-61.
- Hiller E: BTK-Inhibitoren im direkten Vergleich. Acalabrutinib versus Ibrutinib bei Patienten mit vorbehandelter CLL. Info Hämatologie + Onkologie 2022; 25 (12).
- Hoechstetter M, Staber P. Calquence® bei chronischer lymphatischer Leukämie (CLL). Thieme Praxis Report 2021;13(10):1-16.
- Gebrauchsinformation für Patienten Calquence® 100 mg Filmtabletten, Stand: Februar 2023.
- EMA (European Medicines Agency): Produktinformation Calquence 100 mg Hartkapseln. Online unter https://www.ema.europa.eu/en/documents/product-information/calquence-epar-product-information_de.pdf (letzter Aufruf: Mai 2023).
- Sharma S et al. Bioequivalence and relative bioavailability studies to assess a new acalabrutinib formulation that enables coadministration with proton-pump inhibitors. Clin Pharmacol Drug Dev 2022;11(11):1294–1307.
- Sharma S et al. New Acalabrutinib Formulation Enables Co-Administration with Proton Pump Inhibitors and Dosing in Patients Unable to Swallow Capsules (ELEVATE-PLUS). Blood (2021) 138 (Supplement 1): 4365.
Abkürzungen:
AUC = Area under the curve
BTK = Bruton-Tyrosinkinase
BTKi = Bruton-Tyrosinkinase-Inhibitor
CLL = Chronische lymphatische Leukämie
DE-58688/23
 Abbildung 1: Die Einnahme der neuen Filmtabletten unterscheidet sich nicht von den bisherigen Kapseln.1
Abbildung 1: Die Einnahme der neuen Filmtabletten unterscheidet sich nicht von den bisherigen Kapseln.1


