- Kay NE et al. CLL update 2022: A continuing evolution in care. Blood Rev 2022;100930
- Al-Sawaf O. BTK-Inhibitoren bei chronischer lymphatischer Leukämie (CLL): Gegenwart und Zukunft
- Wendtner CM et al. Onkopedia-Leitlinie Chronische Lymphatische Leukämie (CLL). Stand: September 2020
- Brem EA, O´Brien S. Is a BTKi or BCL2i preferable for first “novel” therapy in CLL? The case for BTKis. Blood Adv 2022;6(4):1361-4
- Sharman JP et al. Understanding Ibrutinib Treatment Discontinuation Patterns for Chronic Lymphocytic Leukemia. Blood 2017;130:4060 (ASH Abstr)
- Barf T et al. Acalabrutinib (ACP-196): A Covalent Bruton Tyrosine Kinase Inhibitor with a Differentiated Selectivity and In Vivo Potency Profile. J Pharmacol Exp Ther 2017;363:240-52
- Herman SEM et al. The Bruton’s tyrosine kinase (BTK) inhibitor acalabrutinib demonstrates potent on-target effects and efficacy in two mouse models of chronic lymphocytic leukemia. Clin Cancer Res 2017;23(11):2831-41
- Byrd JC et al. Acalabrutinib (ACP-196) in Relapsed Chronic Lymphocytic Leukemia. N Engl J Med 2016;374(4):323-32
- Nicolson PLR et al. Inhibition of Btk by Btk-specific concentrations of ibrutinib and acalabrutinib delays but does not block platelet aggregation mediated by glycoprotein VI. Haematologica 2018;103(12):2097-108
- Liu Z et al. Distinct BTK inhibitors differentially induce apoptosis but similarly suppress chemotaxis and lipid accumulation in mantle cell lymphoma. BMC Cancer 2021;21(1):732
- Kaptein A et al. Potency and Selectivity of BTK Inhibitors in Clinical Development for B-Cell Malignancies. Blood 2018;132(Suppl_1):1871
- Xiao L et al. Ibrutinib-Mediated Atrial Fibrillation Attributable to Inhibition of C-Terminal Src Kinase. Circulation 2020;142(25):2443-55
- Estupiñán HY et al. Comparative Analysis of BTK Inhibitors and Mechanisms Underlying Adverse Effects. Front Cell Dev Biol;2021;9:630942
- Sharman JP et al. Acalabrutinib with or without obinutuzumab versus chlorambucil and obinutuzumab for treatment-naive chronic lymphocytic leukaemia (ELEVATE TN): a randomised, controlled, phase 3 trial. Lancet 2020;395(10232):1278-91
- Ghia P et al. ASCEND: Phase III, Randomized Trial of Acalabrutinib Versus Idelalisib Plus Rituximab or Bendamustine Plus Rituximab in Relapsed or Refractory Chronic Lymphocytic Leukemia. J Clin Oncol 2020;38(25):2849-61
- Fachinformation Calquence®; Stand: November 2021
- Sharman JP et al. Acalabrutinib ± obinutuzumab versus obinutuzumab + chlorambucil in treatment-naïve chronic lymphocytic leukemia: Elevate-TN four-year follow up. J Clin Oncol 2021;39(Suppl_15):7509
- Jurczak W et al. Acalabrutinib vs Rituximab plus Idelalisib or Bendamustine in Relapsed/Refractory Chronic Lymphocytic Leukemia: A Three-Year Follow-Up of the ASCEND Trial. Blood 2021;138(Suppl_1):393
- Byrd JC et al. Acalabrutinib Versus Ibrutinib in Previously Treated Chronic Lymphocytic Leukemia: Results of the First Randomized Phase III Trial. J Clin Oncol 2021;JCO2101210
- Hillmen P et al. First results of a Head-to-Head trial of acalabrutinib versus ibrutinib in previously treated chronic lymphocytic leukaemia. EHA Library. Hillmen P. 06/09/21;324553;S145
- DGHO. ASCO 2021 – Wichtig zu wissen. Chronische Lymphatische Leukämie (CLL). Acalabrutinib oder Ibrutinib bei Patient*innen mit vorbehandelter CLL (ELEVATE-RR, Byrd et al., Abstract 7500). https://www.dgho.de/aktuelles/news/news/2022/download/asco-2021-cll.pdf
- Wierda WG et al. Frontline Therapy for CLL: Treatment Selection Based on Patient and Treatment Factors. OncLive. February 7, 2022. https://www.onclive.com/view/frontline-therapy-for-cll-treatment-selection-based-on-patient-and-treatment-factors (Zugriff am 04.03.2022)
BTKi-Therapie der CLL: höhere Selektivität gibt den Ausschlag
Bei den Behandlungsoptionen für Patienten mit CLL spielt der zielgerichtete Ansatz, insbesondere die BTK-Inhibition, heute eine dominierende Rolle. Dabei gewinnt Acalabrutinib, der BTKi der zweiten Generation, immer mehr an Bedeutung. Weshalb?
Kernpunkte:
- Bei der CLL-Therapie mit BTKi ist neben der Wirksamkeit auch die Verträglichkeit ein entscheidender Faktor.
- BTK-Inhibitoren der ersten und zweiten Generation weisen differenzierte Verträglichkeitsprofile auf, was von Expert:innen auf die unterschiedliche Target-Selektivität zurückgeführt wird. (Quelle: Estupinan et al.)13 Der in Leitlinien als ein neuer Therapiestandard empfohlene Einsatz von Acalabrutinib als Mono- oder Kombinationstherapie basiert auf einer soliden medizinischen Evidenz.
Hohe Dynamik in der CLL-Therapie
Durch den extremen medizinischen Fortschritt der letzten 20 Jahre entwickelte sich die therapeutische Versorgung von Patienten mit chronischer lymphatischer Leukämie (CLL) rasant weiter. Zu Beginn der 2000er Jahre zählten Fludarabin-Cyclophosphamid (FC) und Bendamustin zum Therapiestandard bei CLL, im Jahr 2005 folgte die Etablierung der Chemoimmuntherapie mit FC plus dem Anti-CD20-Antikörper Rituximab (FCR). Mit der Zulassung von Ibrutinib, dem ersten Vertreter der Bruton-Tyrosinkinase-Inhibitoren (BTKi), im Jahr 2014 kam es zu einem Paradigmenwechsel in der CLL-Behandlung hin zu neuen zielgerichteten Therapien.1,2
Zielgerichtete Wirkstoffe, mit denen sich entweder der veränderte B-Zell-Rezeptor-Signalweg oder das antiapoptotisch wirksame BCL2-Protein direkt inhibieren lassen, kommen heute bevorzugt zum Einsatz. Grund dafür sind die zahlreichen Vorteile der zielgerichteten Therapien, etwa in Bezug auf die OS- bzw. PFS-Raten, die gute Wirksamkeit auch beim Vorliegen genetischer Risikofaktoren und die bessere Verträglichkeit. Die Chemoimmuntherapie spielt mittlerweile nur noch eine untergeordnete Rolle.1-3
BTKi im Fokus: Leitlinienempfehlungen und Behandlungspraxis
Im Fokus der aktuellen Onkopedia-Leitlinienempfehlungen für die Erst- und Zweitlinie (1L/2L) stehen unter anderem die BTK-Inhibitoren Acalabrutinib und Ibrutinib: Sie werden als Monotherapie (1L/2L) oder in Kombination mit einem Anti-CD20-Antikörper (1L) über alle Therapielinien hinweg empfohlen. Alternativ kann der BCL2-Inhibitor Venetoclax in Kombination mit einem Anti-CD20-Antikörper (1L: Obinutuzumab; 2L: Rituximab) eingesetzt werden.3 Letztlich orientiert sich die patientenspezifische Therapieentscheidung am Krankheitsgeschehen, den Komorbiditäten des Patienten und an den individuellen Gegebenheiten.4
Für den Erfolg einer Dauertherapie ist die Verträglichkeit entscheidend
Während Ibrutinib als BTKi der ersten Generation nach seiner Zulassung zu einem Paradigmenwechsel der CLL-Therapie führte, hat sich Acalabrutinib innerhalb kurzer Zeit als ein primus inter pares in der dynamischen Therapielandschaft der CLL etabliert. Das günstigere Sicherheits- und Verträglichkeitsprofil des hochselektiven BTKi der zweiten Generation begründen diese Entwicklung, da sich im realen Versorgungsalltag im Vergleich zu den randomisierten Studien erhöhte Therapieabbruchraten aufgrund von Toxizitäten gezeigt haben.5
Im Unterschied zu Ibrutinib bindet Acalabrutinib nur in einem sehr geringen Ausmaß an andere Kinasen als die BTK. Selbst im Vergleich mit Zanubrutinib, einem anderen Zweitgenerations-BTKi, weist Acalabrutinib eine selektivere Kinase-Inhibierung in vitro auf. Je weniger Off-Targets (v. a. TEC, EGFR, ITK, TXK und Kinasen der Scr-Familie) zum Bindungsspektrum eines BTKi gehören, umso weniger sind Off-Target-Effekte (u. a. EGFR- und T-Zell-Aktivierung) zu erwarten, die mit unerwünschten dermatologischen, immunologischen und kardiovaskulären Ereignissen assoziiert sein könnten.6-13
Acalabrutinib: höchste BTK-Selektivität
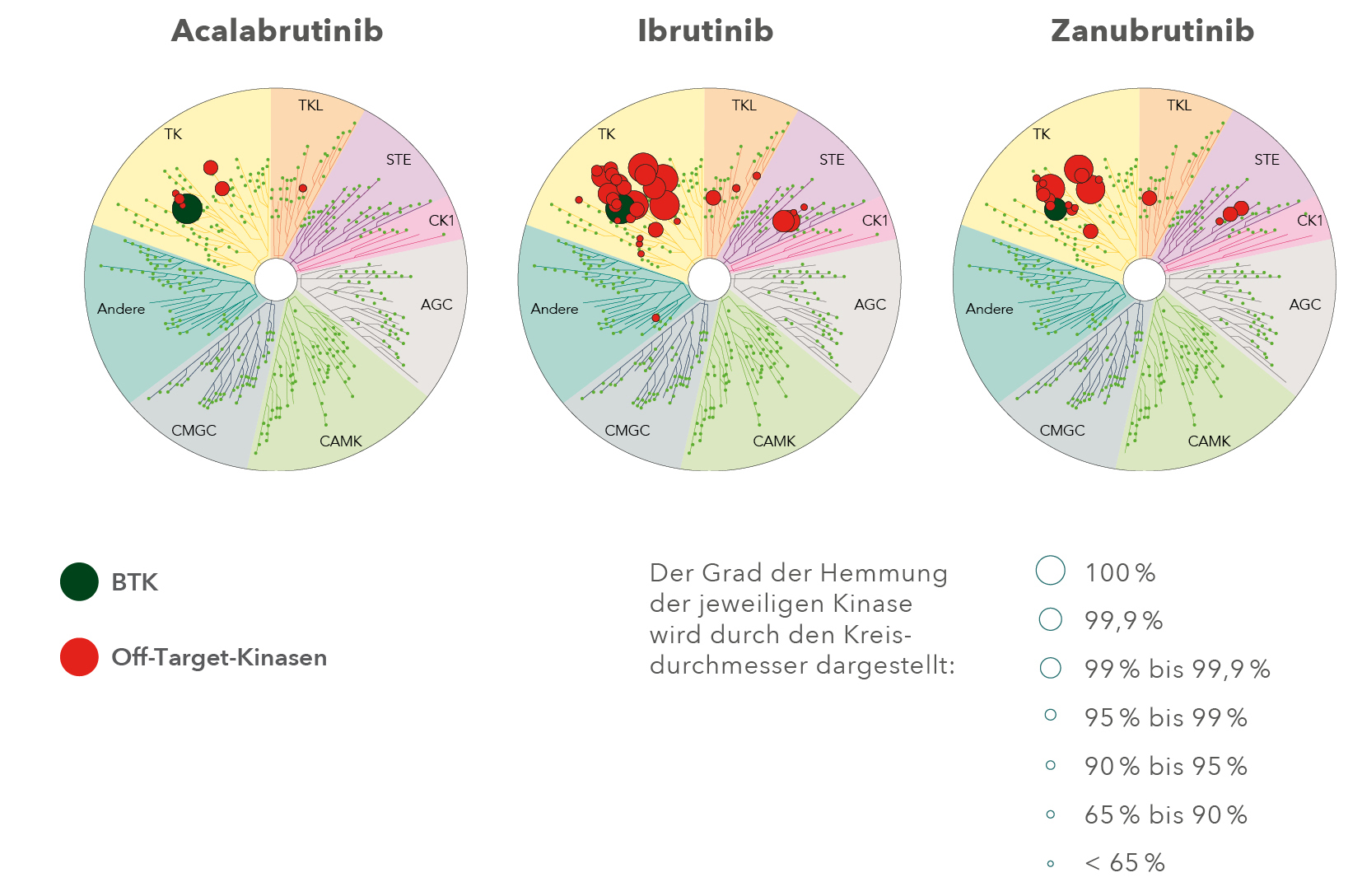
TK = Tyrosinkinasen; TKL = Tyrosinkinase-ähnliche Kinasen; STE = Kinasen mit Ähnlichkeit zu Steril-7, -11 und -20 aus Saccharomyces cerevisiae
Kinase-Profile der BTK-Inhibitoren Acalabrutinib, Ibrutinib und Zanubrutinib im Vergleich (kompetitiver Bindungstest mit humanen Kinasen und krankheitsrelevanten Mutanten bei Testung einer Konzentration von 1 μM im Vergleich zu unbehandelter Kontrolle).6-10
ELEVATE TN und ASCEND: Evidenz sorgt für rasche Etablierung von Acalabrutinib
Die Einführung und Etablierung von Acalabrutinib im klinischen Alltag basiert auf dem Evidenzfundament der Phase-III-Studien ELEVATE TN (therapienaive CLL)14 und ASCEND (rezidivierte/refraktäre CLL)15. Aufgrund der überzeugenden Wirksamkeits- und Sicherheitsdaten wurde Acalabrutinib bereits vor der Zulassung in die aktuelle Onkopedia-Leitlinie der DGHO als neue Therapieoption bei CLL aufgenommen3. Acalabrutinib ist sowohl in der First Line als auch in nachfolgenden Therapielinien in der CLL zugelassen und kann bei allen Patient:innen sinnvoll angewendet werden.16
Mittlerweile liegen für beide zulassungsrelevante Studien die Ergebnisse aus Langzeitbeobachtungen vor, die die starke Wirksamkeit und das konsistente Sicherheitsprofil von Acalabrutinib belegen: 4 Jahre für ELEVATE TN17 und 3 Jahre für ASCEND18.
ELEVATE RR: Vorteile für Acalabrutinib im direkten Head-to-Head-Vergleich
Dass sich die Unterschiede im Bindungsverhalten gegenüber Off-Target-Kinasen auch tatsächlich im klinischen Einsatz zeigen, konnte im ersten Head-to-Head-Vergleich zwischen BTKi´s belegt werden: In der randomisierten, offenen Phase-III-Studie ELEVATE RR zeigte Acalabrutinib bei Nicht-Unterlegenheit hinsichtlich der Wirksamkeit signifikant niedrigere Raten für Vorhofflimmern/-flattern im Vergleich zu Ibrutinib (9 % vs. 16 %, p = 0,02) sowie eine klinisch bedeutsame Reduktion von schweren unerwünschten Ereignissen.19,20
Das beim ASCO 2021 vorgestellte Ergebnis dieser Meilensteinstudie wurde von DGHO-Experten entsprechend bewertet: „Bei rezidivierter/refraktärer CLL haben Ibrutinib und Acalabrutinib ähnliche Wirksamkeit, Acalabrutinib ist besser verträglich.“21 Auch wenn das ELEVATE-RR-Studiendesign die beiden Wirkstoffe in der Zweitlinie miteinander verglich, rechnen klinische Experten mit einer Übertragbarkeit der Daten in die Erstlinientherapie.22
Kernergebnis der Studie ELEVATE RR
| Patienten-kollektiv (n = 533) | Neue Therapie | Kontrolle |
PFS (Median in Monaten) |
OS (Median in Monaten) |
Therapieabbruch aufgrund von UE |
|---|---|---|---|---|---|
| CLL, vorbehandelt, del(17p) oder del(11q) | Acalabrutinib | Ibrutinib |
38,4 vs. 38,4 HR = 1,0 |
n. e. vs. n. e. HR 0,82 (n. s.) |
14,7 % vs. 21,3 % |
Legende: HR = Hazard Ratio; n. e. = nicht erreicht; n. s. = nicht signifikant; PFS = progressionsfreies Überleben; OS = Gesamtüberleben; UE = unerwünschte Ereignisse
Zusammenfassung der ELEVATE-RR-Ergebnisse14 (modifizierte DGHO-Darstellung16)
Fazit für die Praxis: vergleichbare Wirksamkeit bei besserer Verträglichkeit
In einer aktuellen eCME-Fortbildung2 fasst Dr. Othman Al-Sawaf (Universitätsklinikum Köln) die Relevanz der Vergleichsstudie für die Praxis folgendermaßen zusammen:
- Primärer Endpunkt der Nicht-Unterlegenheit mit Acalabrutinib versus Ibrutinib erreicht bei einem medianen progressionsfreien Überleben von 38,4 Monaten.
- Sekundäre Endpunkte mit deutlichem Vorteil für Acalabrutinib:
- Vorhofflimmern unabhängig vom Schweregrad signifikant seltener als unter Ibrutinib.
- Blutungsereignisse in beiden Armen insgesamt häufiger als z. B. unter einer Chemoimmuntherapie, aber unter Acalabrutinib seltener als unter Ibrutinib.
- Wichtig für die Therapieabwägung bei Patienten mit erhöhten kardialen und Blutungsrisiken wegen des durch Vorhofflimmern zusätzlich gesteigerten Risikos für Schlaganfälle und kardiale Komplikationen.
- Rate an Infektionen (interstitielle Lungenerkrankung/Pneumonitis) als weiteres unerwünschtes Ereignis von klinischem Interesse weniger als halb so hoch.
Mit Blick auf die aktuelle Studienlage zur BTKi-Therapie und ihre Implikationen für die Praxis zieht der Experte folgendes Fazit:2
- BTK-Inhibitoren weisen unterschiedliche pharmakokinetische und -dynamische Profile mit unterschiedlichen klinischen Merkmalen auf.
- Mit Acalabrutinib ist es gelungen, einen BTKi mit höherer BTK-Selektivität und minimaler Off-Target-Aktivität für andere Kinasen zu entwickeln, was beim Vergleich mit Ibrutinib in vitro belegt werden konnte.
- Der klinische Head-to-Head-Vergleich von Ibrutinib und Acalabrutinib zeigt eine Nicht-Unterlegenheit im primären Endpunkt (IRC-beurteiltes PFS). Die Rate für Vorhofflimmern (aller Grade) ist unter Acalabrutinib signifikant reduziert.