JAK: Januskinasen
EAA: Enthesitis-assoziierte Arthritis
JPsA: Juvenile Psoriasis-Arthritis
ILAR: International League of Associations for Rheumatology
csDMARD: conventional synthetic Disease-modifying anti-rheumatic drug
bDMARD: biologisches DMARD
DBW: Double blind withdrawal
PBPK: physiologisch basierte Pharmakokinetik
QD: einmal täglich
Olumiant<sup>®</sup>: Neue Zulassung für Kinder ab 2 Jahren
Der JAKi Olumiant<sup>®</sup> ist ab sofort für Kinder ab 2 Jahren bei <strong>juveniler idiopathischer Arthritis (JIA)*</strong> und bei <strong>mittelschwerer bis schwerer pädiatrischer atopischer Dermatitis (Ped AD)<sup>+</sup></strong> zugelassen.<sup>1</sup> Lesen Sie hier mehr zu Wirksamkeit und Sicherheit bei JIA.
Stark für unsere jüngsten Patientinnen und Patienten
Die juvenile idiopathische Arthritis* umfasst eine heterogene Gruppe idiopathischer autoimmuner Arthritiden im Kindheitsalter. Unbehandelt kann sie die Gelenkfunktionalität anhaltend schwächen und die Lebensqualität mindern. Die bisherigen Therapien (NSAR, Glukokortikoide, DMARDs) erzielen oft nicht den gewünschten Erfolg.2
Der JAK-Inhibitor Olumiant® (Baricitinib) ist bereits seit über 6 Jahren für Erwachsene in der Langzeittherapie der Rheumatoiden Arthritis° (RA) zugelassen.1 Durch die starke Wirksamkeit§ und bestätigtem ausgewogenen Sicherheitsprofil# konnte seitdem das Leiden vieler RA-Betroffener langfristig gelindert werden.3-5
Mit der Neuzulassung für die JIA-Indikation können nun auch Kinder ab 2 Jahren von diesen Vorteilen profitieren.
Eckdaten zur Zulassungsstudie:1
- Die Phase-3-Studie wurde randomisiert, doppelblind und Placebo-kontrolliert durchgeführt.
- Eingeschlossen waren Kinder und Jugendliche im Alter von 2 bis < 18 Jahren mit polyartikulärer juveniler idiopathischer Arthritis (polyartikulärer Rheumafaktor positiv [RF+] oder negativ [RF-], erweitert oligoartikulär), EAA oder JPsA gemäß ILAR-Kriterien.
- Die Teilnehmenden hatten zuvor unzureichend auf mindestens ein csDMARD oder bDMARD angesprochen oder ein solches Medikament nicht vertragen.
- Open-Label Einführungsphase: Alle Teilnehmenden (n = 220) erhielten 12 Wochen Olumiant® (4 mg Äquivalentdosisa,b).
- In Woche 12 wurden die Teilnehmenden, die kein pedACR30-Ansprechenc zeigten, aus der Studie ausgeschlossen. Sie konnten an einer offenen Verlängerungsstudie teilnehmen.
- Die pedACR30-Responderd wurden in die doppelblinde Absetzphase (DBW) randomisiert. 82 Teilnehmende erhielten weiter Olumiant® in derselben Dosierung, 81 erhielten ein Placebo.
- Nach insgesamt 44 Wochen wurde als primärer Endpunkt die Zeit bis zum Ausbruch eines Krankheitsschubs erfasst.
Ergebnisse der Zulassungsstudie1
1. Mit Olumiant® blieben knapp 83 % der Betroffenen bis Woche 44 schubfrei
Unter der Therapie mit Olumiant® traten nur bei 17,1 % der Patient:innen Krankheitsschübe auf (vs. Placebo: 50,6 %, p < 0,01). Der Unterschied zeigte sich bereits 4 Wochen nach der Randomisierung (Abb. 1).
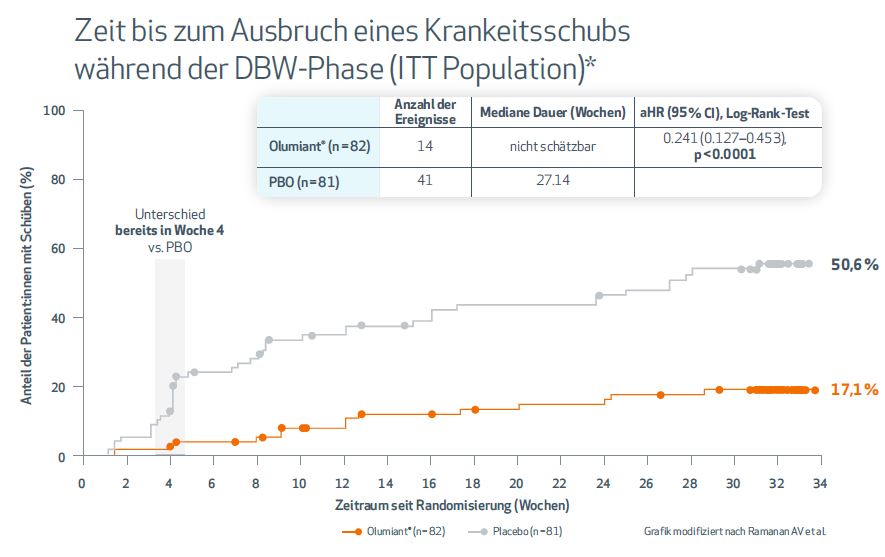
Abbildung 1: Zeit bis zum Ausbruch eines Krankheitsschubs während der DBW-Phase. *Kaplan-Meier-Diagramm der Zeit bis zum Auftreten eines Schubes mit Olumiant® im Vergleich zu Placebo während der DBW-Periode (n = 163). Die Kreise stellen die Patient:innen dar, die die DBW-Periode abbrachen oder beendeten, ohne einen Schub zu erleiden, und deren Daten zum Zeitpunkt ihres Abbruchs oder Abschlusses zensiert wurden. Für den offenen Einführungszeitraum wurden alle Teilnehmer untersucht, die während des offenen Einführungszeitraums mindestens eine Dosis der endgültigen altersabhängigen Dosis eingenommen haben, wie durch pharmakokinetische Untersuchungen des Prüfpräparats bestätigt.
aHR = adjusted Hazard Ratio; CI = Konfidenzintervall; DBW = double-blind withdrawal; ITT = intent-to-treat; PBO = Placebo.
2. Mit Olumiant® erreichten 2 von 3 Patient:innen ein pedACR30-Ansprechen in Woche 44
Bereits in der zweiten Woche der Einführungsphase erreichte ein Großteil der Teilnehmenden ein pedACR30-Ansprechen. Zum Ende des Beobachtungszeitraums hatten 67 % der Teilnehmenden mit Olumiant® ein pedACR30-Ansprechen erreicht – vs. 38 % (1 von 3) mit Placebo, p < 0,01 (Abb. 2).
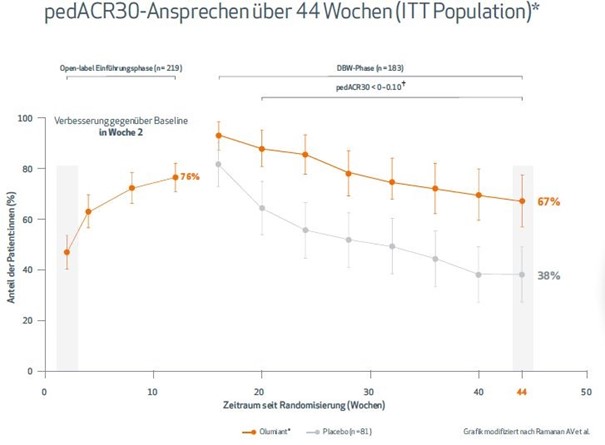
Abbildung 2: pedACR30-Ansprechen über 44 Wochen. * Für den open-label Einführungszeitraum wurden alle Teilnehmer untersucht, die während des open-label Einführungszeitraums mindestens eine Dosis der endgültigen altersabhängigen Dosis eingenommen haben, wie durch pharmakokinetische Untersuchungen des Prüfpräparats bestätigt. † Nominaler p-Wert für Olumiant® im Vergleich zur Placebo-Behandlung bei der angegebenen JIA-ACR-Ansprechschwelle.
DBW = double-blind withdrawal; ITT = intent-to-treat; pedACR30= American College of Rheumatology response level (30% Ansprechen); PBO = Placebo.
3. Keine neuen Sicherheitssignale
Das Sicherheitsprofil im Rahmen der JIA-Zulassungsstudie entspricht den Erfahrungen zur Sicherheit und Verträglichkeit von Olumiant® bei Erwachsenen mit RA.2,#.
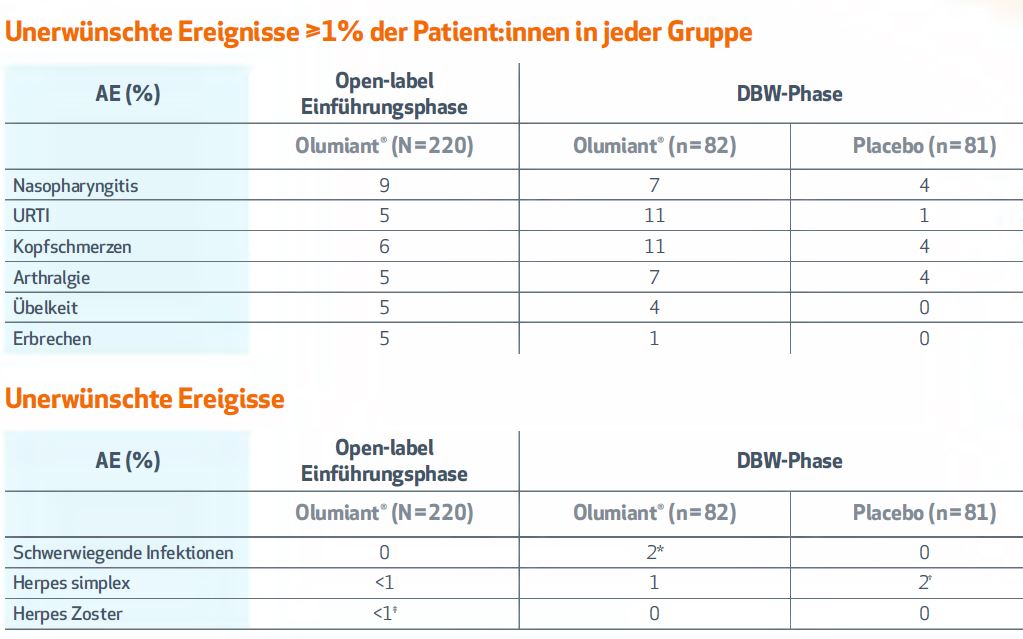
Abbildung 3: Unerwünschte Ereignisse während der Zulassungsstudie. Modifiziert nach 2,6. * Schwerwiegende, durch die Behandlung ausgelöste Infektionen waren COVID-19 und Gastroenteritis (jeweils ein Patient:in). † Ein Patient:in in der Placebogruppe wurde mit einer leichten Herpesinfektion des linken Augenlids gemeldet; nach medizinischer Überprüfung wurde dies als mögliche opportunistische Herpes-Zoster-Infektion mit Augenbeteiligung und zwei nicht zusammenhängenden Dermatomen betrachtet. Bei einem Patienten wurde eine Herpes-Zoster-Infektion gemeldet; nach ärztlicher Überprüfung wurde der Fall nicht als opportunistische Infektion eingestuft.
Fazit
Olumiant konnte in der JIA-Zulassungsstudie seine signifikante Wirksamkeit gegenüber Placebo zeigen: Unter Olumiant® traten im insgesamt 44-wöchigen Beobachtungszeitraum weniger Krankheitsschübe auf und mehr Betroffene erreichten ein pedACR30-Ansprechen als in der Kontrollgruppe. Die orale Einnahme ist außerdem ein wichtiger Schritt für die Vereinfachung, Akzeptanz und Adhärenz, gerade bei Kindern.2
Abkürzungen
Fußnoten
* Olumiant® wird angewendet zur Behandlung der aktiven juvenilen idiopathischen Arthritis bei Patienten ab 2 Jahren, die zuvor unzureichend auf eines oder mehrere herkömmlich synthetische oder biologische DMARDs angesprochen oder diese nicht vertragen haben: Polyartikuläre juvenile idiopathische Arthritis (polyartikulärer Rheumafaktor positiv [RF+] oder negativ [RF-], erweitert oligoartikulär); Enthesitis-assoziierte Arthritis; Juvenile Psoriasis-Arthritis. Olumiant® kann als Monotherapie oder in Kombination mit Methotrexat eingesetzt werden.
+ Baricitinib wird angewendet zur Behandlung von mittelschwerer bis schwerer atopischer Dermatitis bei erwachsenen und pädiatrischen Patienten ab 2 Jahren, die für eine systemische Therapie infragekommen.
° Olumiant® wird angewendet zur Behandlung von mittelschwerer bis schwerer aktiver rheumatoider Arthritis bei erwachsenen Patienten, die auf eine vorangegangene Behandlung mit einem oder mehreren krankheitsmodifizierenden Antirheumatika (DMARDs) unzureichend angesprochen oder diese nicht vertragen haben. Olumiant® kann als Monotherapie oder in Kombination mit Methotrexat eingesetzt werden.
§ Signifikant überlegenes ACR20-Ansprechen vs. Adalimumab in Woche 12.3 Signifikant schnellere und stärkere Schmerzreduktion vs. Adalimumab bereits in Woche 2 und über 52 Wochen anhaltend.3
# Für diese Patientenpopulationen gelten besondere Warnhinweise, Vorsichtsmaßnahmen laut aktueller Fachinformation: Patienten mit atherosklerotischen Herz-Kreislauferkrankungen oder kardiovaskulären Risikofaktoren (z. B. Raucher oder ehemalige Langzeitraucher), Patienten mit Risikofaktoren für maligne Erkrankungen (z. B. bestehendes Malignom oder Malignom in der Vorgeschichte), Patienten ab 65 Jahren und Patienten mit aktiven, chronischen bzw. wiederkehrenden Infekten in der Vorgeschichte.
a Die vorhergesagten Konzentrations-/Zeitdaten bei Patienten mit RA wurden mithilfe von PBPK-Modellen simuliert. Die Modellierung sagte voraus, dass die Olumiant-Konzentrationen bei Jugendlichen im Alter von 12 bis < 18 Jahren und bei Kindern im Alter von 6 bis < 12 Jahren denen von Erwachsenen ähneln würden; daher wurden diese Patienten zunächst mit 4 mg QD dosiert. Im Gegensatz dazu würde man erwarten, dass die Konzentrationen bei Kindern im Alter von < 6 Jahren am oberen Ende des bei Erwachsenen beobachteten Bereichs liegen; daher erhielt diese Patientengruppe zunächst eine niedrigere Dosis von 2 mg QD.
b Altersgerechte Dosen wurden verabreicht, um eine Dosis zu erreichen, die Olumiant 4 mg entspricht.
c pedACR30: American College of Rheumatology, 30 % Ansprechrate
d pedACR30-Responder: Patient:innen, die ein 30 %-iges ACR-Ansprechen erreichten
Quellen
- Aktuelle Olumiant® Fachinformation
- Ramanan AV, et al. Lancet 2023;Epub (incl. SupplMat)(v1.0).
- Taylor PC, et al. N Engl J Med 2017;376:652-662 (plus supplementary material).
- Smolen JS, et al. Rheumatology (Oxford) 2021;60:2256–66.
- Taylor PC, et al. Ann Rheum Dis 2022;81(3):335-343.
- Torrelo A et al Br J Dermatol 2023 Epub Incl Suppl Mat (v1.0).
PP-BA-DE-4086