Normaler CRP ist Prädiktor für geringes Ansprechen auf TNFi
Hohe Krankheitslast trotz normalem CRP-Wert? Erfahren Sie, warum TNF-Inhibitoren bei axSpA-Patient:innen* oft nicht den gewünschten Erfolg bringen und welche Therapieoptionen auch bei normalem CRP-Wert wirksam sind.
Hohe Krankheitslast bei axSpA – wenn csDMARD versagen
Bei vielen Patient:innen mit axialer Spondyloarthritis* (axSpA) führt eine Behandlung mit konventionellen Therapien nicht zu einer dauerhaften Linderung der Beschwerden.
Die aktuellen Leitlinien von ASAS und EULAR empfehlen in diesem Fall den Einsatz eines TNF-, IL-17- oder JAK-Inhibitors und stufen alle drei Möglichkeiten als gleichwertig ein.1 In der Praxis werden TNFI oft zuerst verschrieben – eine Entscheidung, die häufig nicht den gewünschten Erfolg erzielt: Bis zu 68 % der Patient:innen brechen die TNFi-Therapie wegen nachlassender oder unzureichender Wirksamkeit ab, wie Real-World-Daten zeigen.2
Entscheidungshilfen bei der Therapiewahl
Was hilft, ein individuell geeignetes Therapeutikum zu finden, um den Betroffenen solche „Sackgassen“ zu ersparen? Eine Möglichkeit stellt der CRP-Wert dar: Gemäß Leitlinie gilt ein erhöhter CRP-Wert als Prädiktor für ein Ansprechen auf TNFi.1 Patient:innen mit einem normalen CRP-Wert haben dagegen geringere Chancen, von einer TNFi-Therapie zu profitieren.3,4,5
CRP wichtigster Prädiktor für ein geringes Ansprechen auf TNFi
Prädiktive Modelle können Faktoren für das Therapieansprechen identifizieren. Im Rahmen einer Metaanalyse mit Daten von 1.899 r-axSpA-Patient:innen aus 10 randomisierten Studien wurde ein Vorhersagemodell für das Ansprechen auf TNFi nach 12 Wochen entwickelt. Ein Ansprechen wurde als Reduktion des ASDASa um ≥ 2 definiert, ein Nicht-Ansprechen als eine Senkung um < 1,1. Unter allen getesteten Prädiktoren zeigte der CRP-Wert die höchste Aussagekraft.3 R-axSpA-Patient:innen mit einem erhöhten CRP-Wert hatten eine höhere Wahrscheinlichkeit für ein signifikantes Ansprechen auf TNFi.3
Umgekehrt weisen Daten darauf hin, dass Patient:innen mit einem normalen CRP-Wert eine geringere Wahrscheinlichkeit haben könnten, auf eine TNFi-Therapie anzusprechen.3,4,5
Weitere Studien liefern ähnliche Hinweise bei nr-axSpA-Patient:innen. In der Phase-III-Studie ABILITY-1, die die Wirksamkeit von Adalimumab bei nr-axSpA untersuchte, wurde unter anderem der CRP-Wert erhoben. Eine nach CRP-Wert stratifizierte Subgruppen-Analyse zeigte ein geringeres Ansprechen auf TNFi bei Patient:innen mit normalem CRP-Wert: Nur 27 % der Patient:innen mit normalem CRP-Wert erreichten nach 12 Wochen ein ASAS40-Ansprechenb (im Vergleich zu 18 % im Placebo-Arm). Bei erhöhtem CRP-Wert waren es 55 % (vs. 11 % unter Placebo; Abb. 1).5
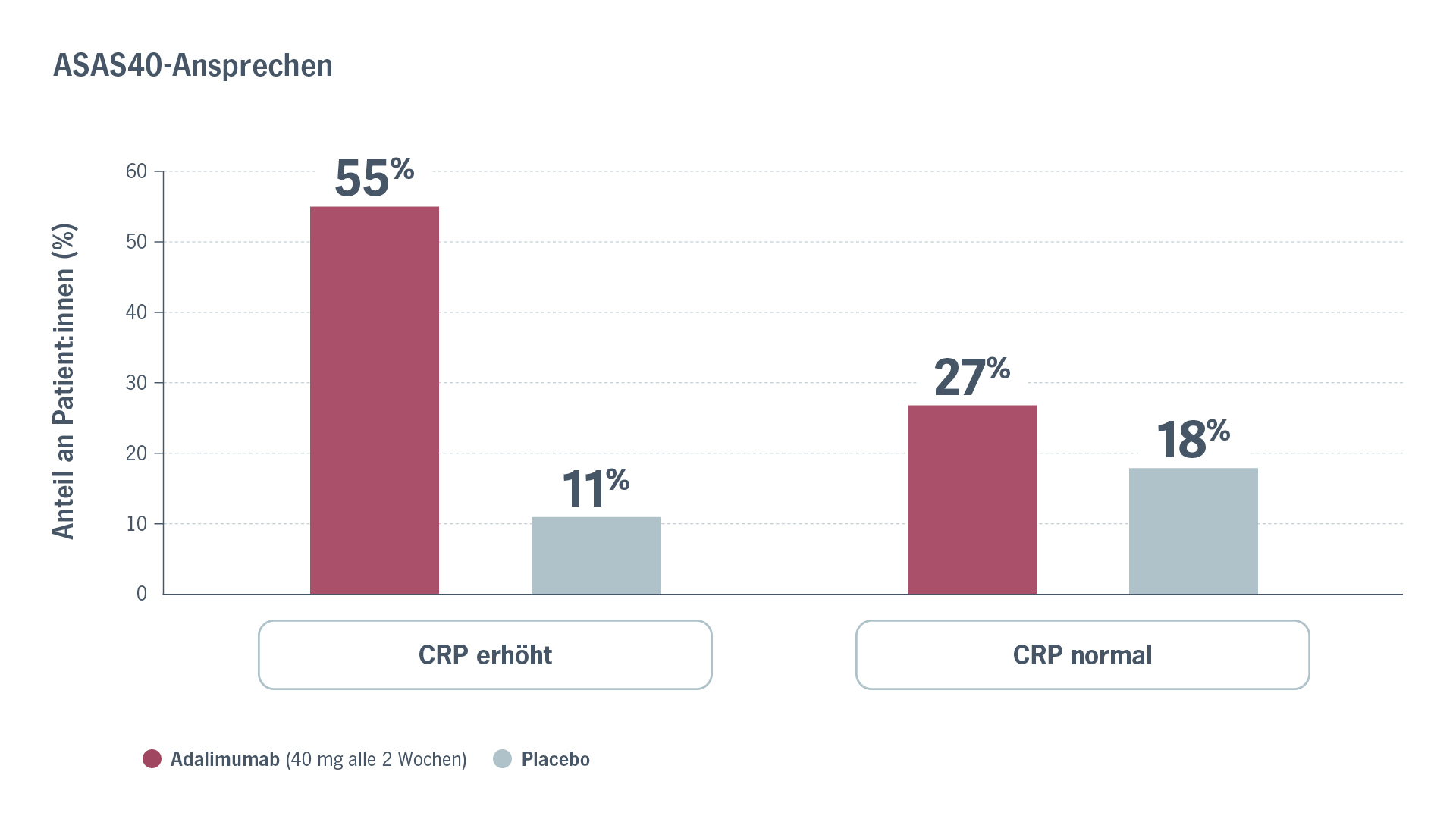
Abb. 1. Der Anteil der Patient:innen mit ASAS40-Ansprechen nach 12 Wochen Adalimumab-Therapie war in der ABILITY-1-Studie bei erhöhtem CRP-Wert größer als bei normalem CRP-Wert. Modifiziert nach Sieper, J 2013.5
Hohe Krankheitslast trotz normalem CRP-Wert
Viele axSpA-Patient:innen haben aber keinen erhöhten CRP-Wert, wie Registerstudien zeigen.6,7,8 40 bis 60 % der r-axSpA-Patient:innen haben normale CRP-Werte.8 Bei nr-axSpA-Patient:innen waren es sogar zwei Drittel.7 Da axSpA-Patient:innen mit normalem CRP-Wert ähnlich stark unter den Symptomen leiden können wie Patient:innen mit erhöhtem CRP-Wert, ist es wichtig, auch diesen Betroffenen eine wirksame Therapie zu ermöglichen.8,9 Es besteht also ein Bedarf an Therapien, die sowohl bei erhöhtem als auch normalem CRP-Wert wirksam sind.
Ixekizumab ist unabhängig vom CRP-Wert wirksam
Mit dem IL-17A-Inhibitor Ixekizumab (Taltz®) steht eine CRP-unabhängig wirksame Therapie zur Verfügung. Dies zeigt eine Post-hoc-Analyse der COAST-V-Studie.10
35 % der Patient:innen mit normalem CRP-Wert erreichten unter Ixekizumab ein ASAS40-Ansprechen – nahezu doppelt so viele wie unter Placebo (Abb. 2). Der im Referenzarm mitgeführte TNFi Adalimumab zeigte dagegen nur ein Ansprechen auf Placebo-Niveau (21 %). Von den Patient:innen mit erhöhtem CRP-Wert erreichten sogar 56 % unter Ixekizumab ein ASAS40-Ansprechen und damit signifikant mehr als unter Placebo (p < 0,001).10
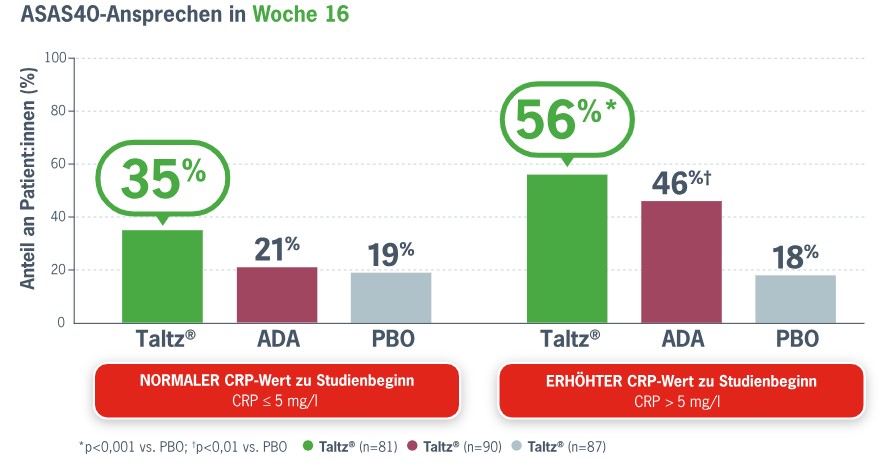
Abb. 2. Anteil der Biologika-naiven r-axSpA-Patient:innen mit einem ASAS40-Ansprechen nach 16 Wochen in der COAST-V-Studie. Modifiziert nach Maksymowych WP, 202210.
In diesem Kurzvideo beschreibt PD Dr. David Simon, Charité Berlin, welche Bedeutung er dem CRP-Wertes in seiner Praxis beimisst:

Fazit:
- axSpA-Patient:innen weisen häufig keinen erhöhten CRP-Wert auf und leiden dennoch an einer hohen Krankheitslast.
- Eine Therapie, die unabhängig vom CRP-Wert wirksam ist, wie der IL-17i Ixekizumab, kann vor allem auch in diesen Fällen eine wertvolle Behandlungsoption sein.
* Axiale Spondyloarthritis (axSpA): Ankylosierende Spondylitis (röntgenologische axiale Spondyloarthritis): Taltz® (Ixekizumab) ist angezeigt für die Behandlung erwachsener Patienten mit aktiver röntgenologischer axialer Spondyloarthritis (r-axSpA), die auf eine konventionelle Therapie unzureichend angesprochen haben. Nicht-röntgenologische axiale Spondyloarthritis (nr-axSpA): Taltz® (Ixekizumab) ist angezeigt für die Behandlung erwachsener Patienten mit aktiver nicht-röntgenologischer axialer Spondyloarthritis mit objektiven Anzeichen einer Entzündung, nachgewiesen durch erhöhtes C-reaktives Protein und/oder Magnetresonanztomographie, die unzureichend auf nichtsteroidale Antirheumatika angesprochen haben.
a ASDAS: Ankylosing Spondylitis Disease Activity Score
b ASAS: Assessment of SpondyloArthritis international Society
TNFi: Tumornekrosefaktor-Inhibitoren
CRP: C-reaktives Protein
IL-17i: Interleukin-17-Inhibitoren
JAKi: Januskinasen-Inhibitoren
r-axSpA: röntgenologische axiale Spondyloarthritis
nr-axSpA: nicht- röntgenologische axiale Spondyloarthritis
- Ramiro S, et al. Ann Rheum Dis 2023;82(1):19–34.
- Deodhar A, et al. Semin Arthritis Rheum 2017;47:343–350.
- Wang R, et al. JAMA Netw Open 2022;5: e222312.
- Sieper J, et al. Arthritis Rheumatol 2015;67(10):2702–
- Sieper J, et al. Ann Rheum Dis 2013;72:815–822.
- Mease PJ, et al. 2018;70(11):1661–1670.
- Poddubnyy D, et al. Rheumatology (Oxford) 2022;3;61(8):3299–3308.
- Poddubnyy D, et al. Ann Rheum Dis 2010;69:1338–41.
- Sengupta R, et al. ACR 2024; Poster P1475.
- Maksymowych WP, et al. Rheumatology (Oxford) 2022;61:4324–4334.
PP-IX-DE-5071


