BASDAI: Bath Ankylosing Spondylitis Disease Activity Index
ASDAS: Ankylosing Spondylitis Disease Activity Score
PASI: Psoriasis Area Severity Index
CRP: C-reaktives Protein
EULAR: European Alliance of Associations for Rheumatology
GRAPPA: Group for Research and Assessment of Psoriasis and Psoriatic Arthritis
IL17-A: Interleukin 17-A
DAPSA versus MDA: Welches Messinstrument bietet mehr?
Um den Therapiefortschritt bei Psoriasis-Arthritis<sup>+</sup> objektiv beurteilen zu können, sind messbare Parameter zur Bewertung der Krankheitsaktivität entscheidend. Die von den Fachgesellschaften am häufigsten empfohlenen Scores sind DAPSA und MDA.
Treat-to-Target in der PsA+ – Aber was genau ist das Ziel?
Der Treat-to-Target (T2T)-Ansatz beinhaltet die Definition eines festen Behandlungsziels und Regeln für kontinuierliches Monitoring und Therapieanpassungen.1 Nachdem sich die T2T-Strategie in der Behandlung rheumatoider Arthritis (RA) bewährt hat, gewinnt sie auch für die Psoriasis-Arthritis (PsA) immer mehr an Bedeutung.1 Stellt sich nur die Frage, welche Ziele Behandelnde und Patient:innen anvisieren sollten?
Die Mitglieder einer internationalen und interdisziplinären Task Force haben 2018 mit einer großen Mehrheit als Hauptziel der PsA-Behandlung die Remission (inaktive Erkrankung) beziehungsweise alternativ eine niedrige bzw. minimale Krankheitsaktivität definiert.2
Wie wird der Therapiefortschritt gemessen?
Um den Erfolg – oder Misserfolg – einer Behandlung objektiv beurteilen zu können, bediente man sich zunächst Scores, die bereits in der Therapie der rheumatoiden Arthritis oder der Psoriasis angewendet wurden und Aufschluss über den Behandlungserfolg mit Blick auf einzelne Manifestationen geben. Dazu gehören zum Beispiel der BASDAI- und der ASDAS-Score zur Beurteilung der axialen Beteiligung oder der PASI-Index zur Beurteilung der Hautsymptomatik.3 Die Gelenke wurden unabhängig davon beurteilt.
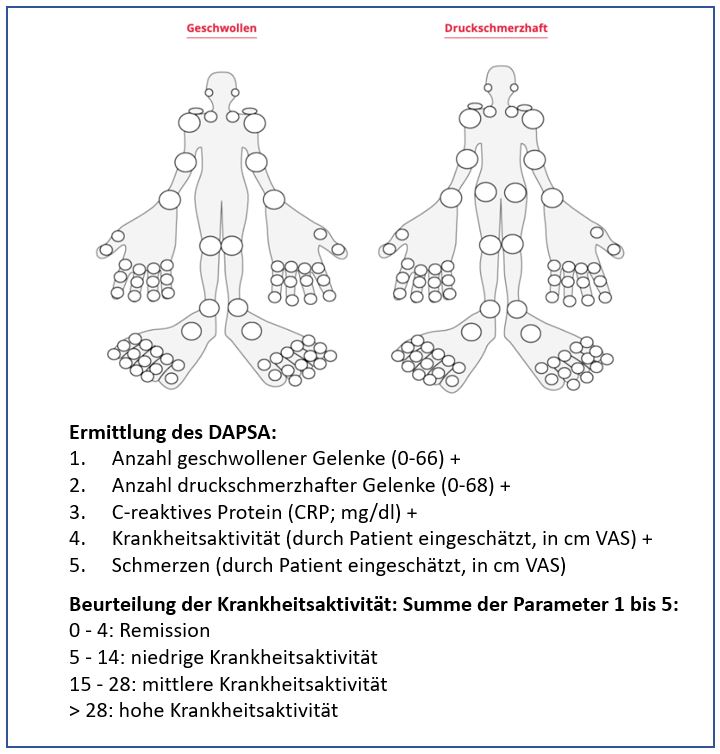
Seit 2010 steht als kombinierter Score der DAPSA (Disease Activity in Psoriatic Arthritis)-Score zur Beurteilung der Krankheitsaktivität zur Verfügung. Er umfasst die Anzahl geschwollener und druckschmerzhafter Gelenke, die vom Patienten eingeschätzte Krankheitsaktivität, die Schmerzintensität und den CRP-Wert
(Abb. 1).4
Abbildung 1: Ermittlung des DAPSA-Scores und daraus folgende Beurteilung der Krankheitsaktivität. VAS: Visual Analog Scale. Modifiziert nach Smolen et al., 2015.3
Im selben Jahr wurde ein weiterer zusammengesetzter Index zur Beurteilung der Krankheitsaktivität entwickelt: Für das Erreichen einer minimalen Krankheitsaktivität (MDA) legten Coates und Kollegen 7 Kriterien fest, von denen 5 zutreffend sein müssen, um die Definition einer MDA zu erfüllen (Abbildung 2).5 Sind alle 7 Kriterien erfüllt, spricht man von einer VLDA (Very Low Disease Activity). Diese ist mit einer DAPSA-Remission (Wert 0 - 4) vergleichbar.5
Der MDA-Index kombiniert die Beteiligung derGelenke mit Enthesitis, Hautsymptomen und der körperlichen Funktionsfähigkeit, verzichtet aber auf die Beurteilung des CRP-Wertes.
Abbildung 2: Kriterien für das Erreichen einer MDA. Modifiziert nach Coates LC et al., 2010.5 PASI: Psoriasis Area Severity Index; sPGA: static Physician Global Assessment; BSA: Body Surface Area; HAQ-DI: Health Assessment Questionnaire-Disability Index; VAS: Visual Analog Scale.
Neben dem DAPSA und MDA wurden auch andere zusammengesetzte Indices in klinischen PsA-Studien verwendet; jedoch empfehlen sowohl die T2T Task Force, als auch EULAR und GRAPPA entweder den DAPSA oder den MDA als am besten geeignetes Messinstrument, um eine Remission oder niedrige Krankheitsaktivität festzustellen.6
Welches Maß anlegen? DAPSA oder MDA?
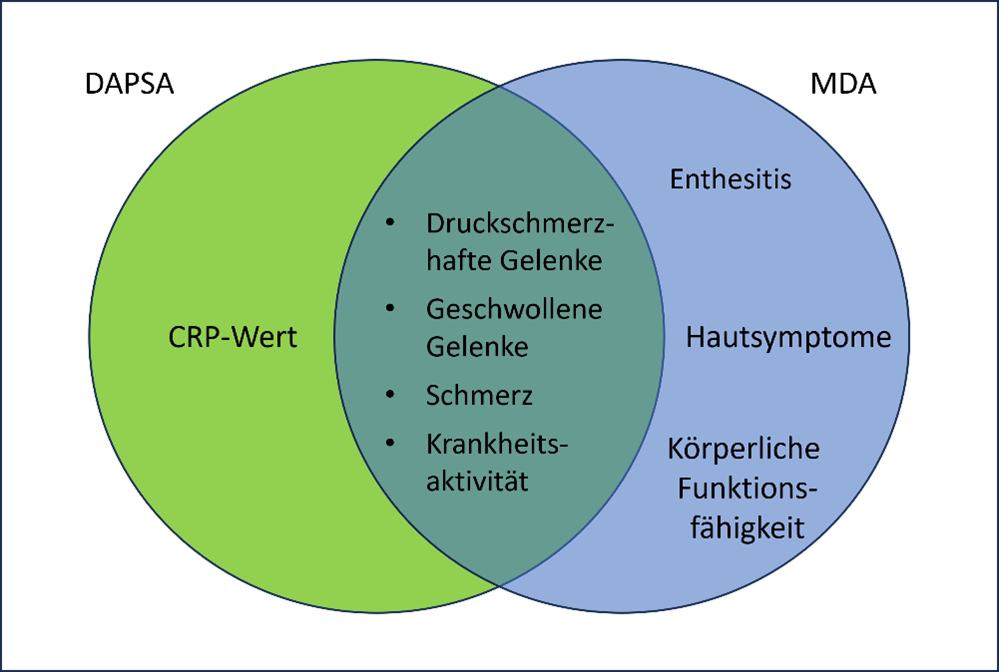
Den Gelenkstatus, die Schmerzintensität und die Krankheitsaktivität decken beide Messinstrumente ab. Wird der MDA-Index als Maßstab herangezogen, bleibt der CRP-Wert unberücksichtigt. Der DAPSA-Score dagegen schließt die Hautsymptomatik, Enthesitis und die körperliche Funktionsfähigkeit nicht mit ein.
Abbildung 3: Überschneidung und Unterschiede von DAPSA und MDA-Index.
Laut aktuellen Empfehlungen sollten alle Krankheitsdomänen einer PsA gleichwertig betrachtet werden und möglichst viele von ihnen parallel behandelt werden.7 Die gleichzeitige Behandlung von Gelenk- und Hautsymptomen hat sich als vorteilhaft erwiesen. Laut Kavanaugh und Kollegen ist sie sogar eine Voraussetzung für die optimale Verbesserung der Lebensqualität von Betroffenen.8 Diese Behandlung lässt sich mit dem MDA-Score besser kontrollieren.
Erreichen Betroffene eine MDA hat dies einen positiven Einfluss auf deren körperliche Funktionsfähigkeit und Lebensqualität:
- Die T2T-Strategie mit einer minimalen Krankheitsaktivität (MDA) als Behandlungsziel führt zu signifikanten Verbesserungen der Gelenk- und Haut-bezogenen Krankheitsaktivität sowie einer besseren körperlichen Funktionsfähigkeit und Lebensqualität im Vergleich zur Standardtherapie.9
- Eine MDA ist ein Prädiktor für eine verbesserte Lebensqualität und Erwerbsfähigkeit.10
- Patient:innen, die langfristig mit einer effektiven Therapie den Zustand einer MDA erreichen, können von einer signifikant geringeren Progression peripherer Gelenkschäden profitieren.11
- Je früher eine MDA erreicht wird, desto besser sind die Aussichten auf eine dauerhaft anhaltende niedrige Krankheitsaktivität.12
Wussten Sie schon?
Der IL-17A-Inhibitor Taltz® zeigt eine schnelle und langfristige Wirksamkeit auf den Symptomkomplex Gelenke und Haut.13,14
Fast 50 % der Patient:innen erreichten in der SPIRIT-H2H-Studie mit Taltz® bereits nach 24 Wochen eine MDA (48 % vs. 35 % unter Adalimumab; p = 0,003).13,14
Dieser Effekt konnte auch langfristig beobachtet werden: In der SPIRIT-P1-Studie konnten 40 % der Biologika-naiven Teilnehmenden unter Taltz® ihr MDA-Ansprechen bis zum Ende des dreijährigen Studienzeitraums aufrechterhalten.15
Fazit
Die Beurteilung der Krankheitsaktivität bei einer PsA mittels MDA-Kriterien bietet den Vorteil, dass auch die bedeutende Krankheitsdomäne Haut einbezogen wird. Mit einer gleichzeitigen Therapie von Gelenk- und Hautsymptomen wird den Betroffenen eine optimale Verbesserung der Lebensqualität ermöglicht.
Wir haben Ihr Interesse geweckt? Ab dem 30.5. finden Sie in unserem Esanum-Kanal einen detaillierten Artikel rund um die MDA unter der Therapie mit Taltz®!
Abkürzungen
Fußnoten
+ Taltz®, allein oder in Kombination mit Methotrexat, ist angezeigt für die Behandlung erwachsener Patienten mit aktiver Psoriasis-Arthritis, die unzureichend auf eine oder mehrere krankheitsmodifizierende Antirheumatika (DMARD) angesprochen oder diese nicht vertragen haben.
Quellen
- Gossec L, et al. Ann Rheum Dis 2020;79:700-712.
- Smolen JS, et al. Ann Rheum Dis 2018;77:3-17.
- Smolen JS, et al. Clin Exp Rheumatol 2015;33(Suppl93):48-50.
- Nell-Duxneuner VP, et al. Ann Rheum Dis 2010;69:546-9.
- Coates LC, et al. Ann Rheum Dis 2010;69:48-553.
- Coates LC, et al. Nat Rev Rheumatol 2020;50:709-718.
- Coates LC, et al. Nat Rev Rheumatol 2022;18:465-479.
- Kavanaugh A, et al. Ann Rheum Dis 2019;78:1215-1219.
- Coates LC, et al. Lancet 2015;386:2489-2498.
- Coates LC, et al. BMC Rheumatol 2018;2:24.
- Coates LC, et al Arthritis Care & Research 2010;62:965-969.
- Snoeck Henkemans, et al. RMD Open 2022;8:e002706.
- Mease PJ, et al. Ann Rheum Dis 2020;79(1):123-131.
- Smolen JS, et al. Ann Rheum Dis 2020;79(10):1310-1319.
- Chandran V, et al. Rheumatology 2020;59:2774-2784.
PP-IX-DE-4206