- Garcia-Pavia P et al. Eur J Heart Fail 2021; 23:512-526
- Yilmaz A et al. Kardiologe 2019; 13:264-291
- Perugini et al. J Am Coll Cardiol 2005; 46(6):1076-1084
- Treglia G et al. Eur J Nucl Med Mol Imaging 2018; 45(11):1945-1955
- Maurer MS et al. Circ Heart Fail. 2019; 12(9):e0006075
- McDonagh TA et al. Eur Heart J 2021; 42(36):3599-3726
- Gillmore JD et al. Circulation 2016; 133:2404-2412
- Maurer MS et al. Circulation 2017;135(14):1357-1377
- Witteles RM et al. J Am Coll Cardiol HF 2019; 7(8):709-716
- Fachinformation Vyndaqel® 61 mg, aktueller Stand
- https://www.amyloidose-verstehen.de/behandlungszentren
Skelettszintigrafie bei kardialer ATTR-Amyloidose: Nicht-invasive Diagnosesicherung
Die Skelettszintigrafie ist bei gleichzeitigem Ausschluss einer Leichtketten-Amyloidose eine nicht-invasive Methode zur Diagnosesicherung bei Transthyretin-Amyloidose mit Kardiomyopathie (ATTR-CM).<sup>1,2</sup> Dazu muss jedoch der richtige Tracer gewählt werden.<sup>3</sup>
Steht bei einer Patientin oder einem Patienten der Verdacht auf die ATTR-CM im Raum, kann eine nuklearmedizinische Methode, die Skelettszintigrafie, mit hoher Sensitivität (95,4 %) und Spezifität (92,2 %) zur nicht-invasiven Diagnosesicherung führen.4
Interdisziplinäre Abklärung der ATTR-CM:
Nuklearmedizin hinzuziehen
Typischerweise kommt es bei der ATTR-CM zur kardialen, häufig auch systemischen, Ablagerung fehlgefalteter und unlöslicher Fibrillen des Proteins Transthyretin.5 Sind kardiologische Hinweise vorhanden, die auf eine Amyloidose hindeuten, ist in der Ganzkörper-Skelettszintigrafie das typische schwarze Erscheinungsbild des Herzens infolge der Tracer-Ablagerungen ein weiteres starkes Indiz für eine ATTR-CM.1-3,6,7
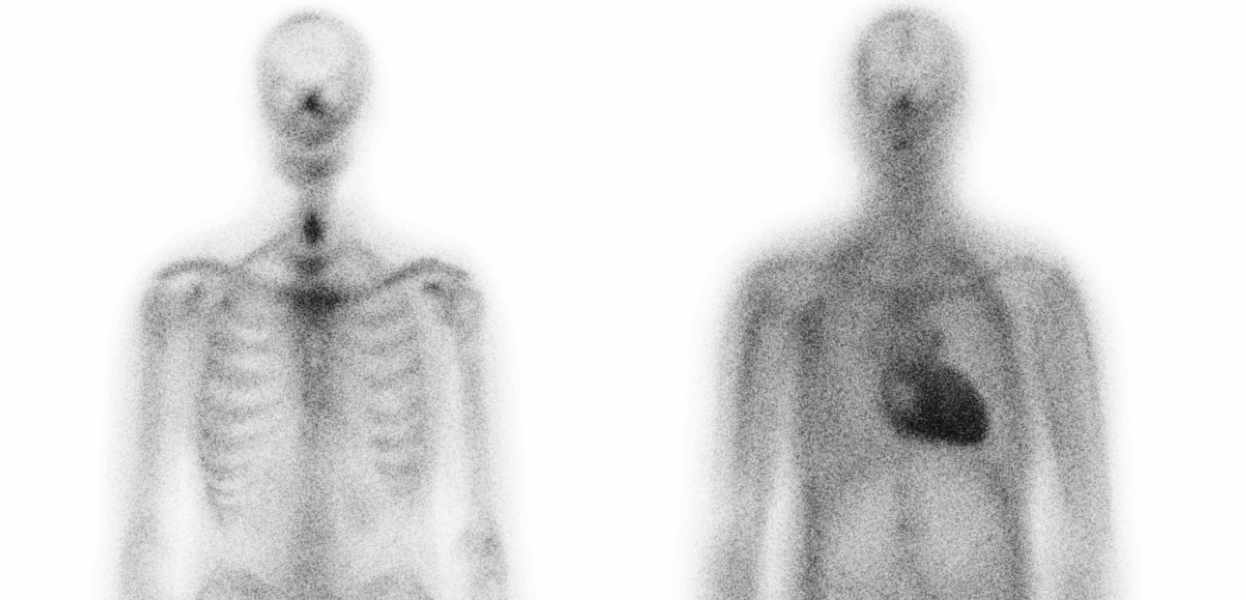
Skelettszintigrafie: links ohne Befund und rechts mit ATTR-CM-Befund (schwarzes Herz)
Quelle: Illustrative Darstellung in Zusammenarbeit mit Torbjörn Sundström, MD, PhD, Radiologie/ Nuklearmedizin, Umeå Universitätsklinik Schweden
Entscheidend für die endgültige Diagnosestellung im Verdachtsfall sind der Perugini-Score sowie die labordiagnostische Prüfung auf eine Leichtketten (AL)-Amyloidose. Bei einem Perugini-Score von 2 oder 3 und gleichzeitigem Ausschluss einer AL-Amyloidose gilt die Diagnose der ATTR-CM als gesichert. Auf eine invasive Myokardbiopsie kann in diesen Fällen verzichtet werden.1-3,6,7
Tracer: Spezielle Anforderungen beachten!
Nicht alle Tracer sind zur Diagnosesicherung geeignet. Daher sollte bereits bei der Zuweisung zur Nuklearmedizin der Hinweis auf den Initialverdacht „ATTR-CM“ geäußert werden. Als aussagekräftige Tracer gelten 99mTc-HMDP, -DPD und -PYP.2 Bewährt habe sich ein Abstand von 2-3 Stunden zwischen Injektion des Tracers und der Aufnahme, empfahl Dr. Imke Schatka, Berlin, auf dem Pfizer-Symposium anlässlich der 61. Jahrestagung der Deutschen Gesellschaft für Nuklearmedizin. Bei einer Wiederholung sei es wichtig, den Abstand der ersten Messung einzuhalten.
Um falsch positive Befunde zu vermeiden und die Tracer-Anreicherung im Herzmuskel zu bestätigen, sollte eine SPECT (Single-Photon-Emissionscomputertomographie)-Untersuchung erfolgen.1
ATTR-CM: häufiger als bisher vermutet
Lange galt die ATTR-CM als seltene Erkrankung, doch Zahlen belegen, dass eine altersbedingte Ablagerung von Transthyretin-Amyloidfibrillen bei ca. einem Viertel der über 80-Jährigen nachweisbar ist. Jedoch geht dies nicht zwangsläufig mit einer ATTR-CM-Symptomatik einher.5 Um die Erkrankung frühzeitig erkennen zu können, ist es wichtig, sich mit den Anzeichen („Red Flags“) der ATTR-CM vertraut zu machen, denn nicht nur kardiale Symptome können auf die systemische Erkrankung hindeuten.1,2,8,9
Reminder: Wann sollte die interdisziplinäre Abklärung initiiert werden?
Als Symptome, bei denen an die ATTR-CM gedacht werden sollte,
gelten unter anderem 1,2,8,9:
- Normo- oder Hypotonie nach vorheriger Hypertonie
- Herzinsuffizienz (HI), die nicht auf die Standardtherapie anspricht
- (beidseitiges) Karpaltunnelsyndrom
- relative Niedervoltage
- Spinalkanalstenose
- Polyneuropathie
- spontane Bizepssehnenruptur
Kausale Therapie bei sicherer Diagnose: Chance auf Verlangsamung der Progression
Als aktuell einzige zugelassene kausale Therapie der ATTR-CM kann Tafamidis 61 mg (Vyndaqel® 61 mg)10 Pflichttext den Fortschritt der Erkrankung verlangsamen. Im Verdachtsfall kann auch die Überweisung an ein spezialisiertes Amyloidosezentrum hilfreich sein, damit die Diagnosesicherung und die Einleitung der kausalen Therapie rasch erfolgen können.11