- Fachinformation Vyndaqel®, aktueller Stand
- Garcia-Pavia P et al. J Card Fail. 2024 Jun 21:S1071-9164(24)00222-7
- Maurer MS et al. N Engl J Med. 2018;379:1007–1016
- Elliot P et al. Circ Heart Fail. 2022 Jan; 15(1): e008193.
Daten des THAOS-Registers bestätigen den Überlebensvorteil mit VYNDAQEL<sup>®</sup> in einem Real-World-Setting
Im Journal of Cardiac Failure publizierte Daten der globalen Beobachtungsstudie THAOS zeigen, dass eine Therapie mit Tafamidis 61 mg (Vyndaqel<sup>®</sup>)<sup>1</sup> auch unter Alltagsbedingungen die Mortalität bei Patient:innen mit Transthyretin-Amyloidose mit Kardiomyopathie (ATTR-CM) verbessern kann.<sup>2 </sup>
Mit Tafamidis 61 mg (Vyndaqel) wurde im Februar 2020 die erste pharmakologische Therapie zur Behandlung der lebensbedrohlichen Amyloidose mit Kardiomyopathie (ATTR-CM) in der EU verfügbar.1
THAOS-Register
- Repräsentative Real-World-Kohorte von 1441 Patient:innen mit ATTR-CM 2
- Numerisch höhere Überlebensrate bei Patient:innen, die Tafamidis® 61 mg erhielten, gegenüber nicht mit Tafamidis® 61 mg behandelten Patient:innen2,*,#
- Insgesamt höhere Überlebensraten im Vergleich zur ATTR-ACT-Studie2
- 5,5-fach weniger Todesfälle bei mit Tafamidis 61mg-behandelten Patient:innen gegenüber unbehandelten Patient:innen innen2

Zulassungsstudie wird bestätigt
In der klinischen Zulassungsstudie ATTR-ACT ermöglichte die Behandlung mit Tafamidis 61 mg im Vergleich zu Placebo nach 30 Monaten eine Überlebensrate von 70,5% - eine Reduktion des Mortalitätsrisikos um 30 %, wobei die Wirksamkeit umso größer war, je früher der Einsatz erfolgte.3,4
THAOS bestätigt Vorteile im Alltag
Die longitudinale, globale Phase-4-Studie THAOS (Transthyretin Amyloidosis Outcomes Survey) wurde zwischen 2007 und 2023 eingerichtet, wobei auch therapienaive Patient:innen mit der Erkrankung teilnehmen konnten.2 Hier finden Sie die wichtigsten Erkenntnisse aus der Studie:
- ⮚ Verbesserung der Überlebensrate
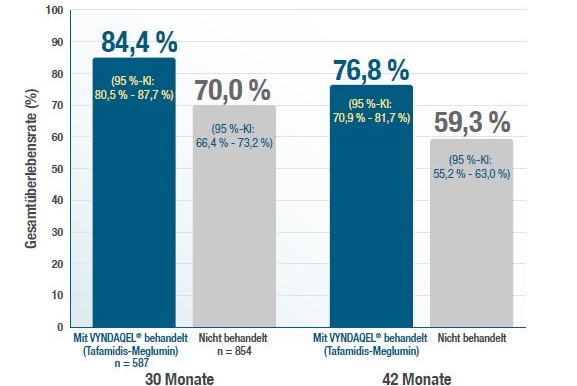
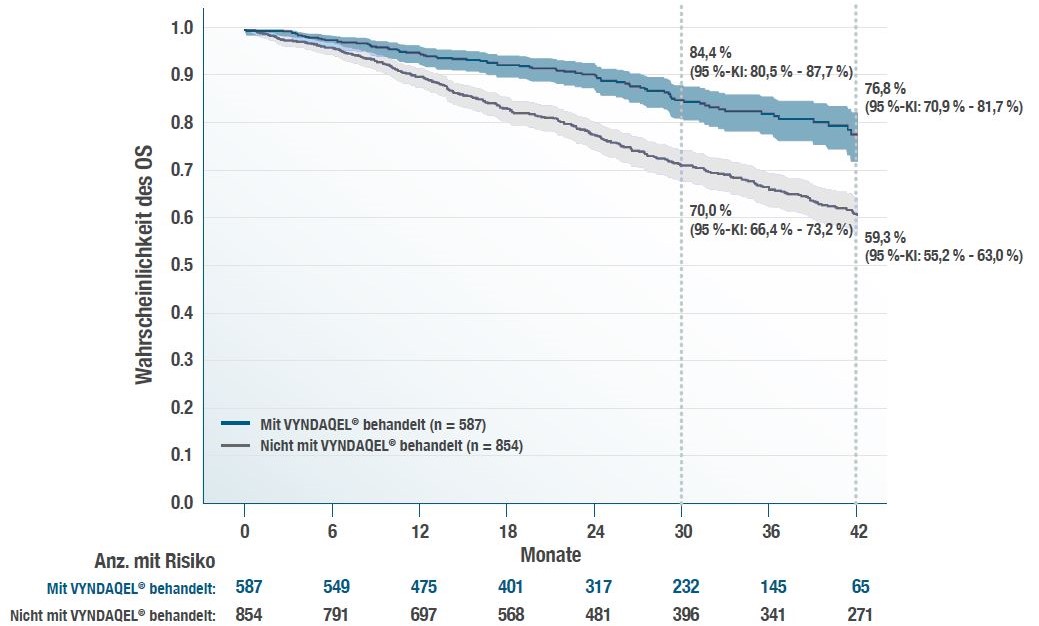
In der nun ausgewerteten THAOS-Kohorte mit 1.441 ATTR-CM-Patient:innen aus 18 Ländern ergaben sich unter der Behandlung mit Tafamidis (n=587) nach einem Follow-Up von 30 bzw. 42 Monaten Überlebensraten von jeweils 83,1 % (95 %-KI: 78,4–87,0) und 81,1 % (75,7–85,4) gegenüber 70,0 % (66,4–73,2) und 59,3 % (55,2–63,0) bei unbehandelten Patient:innen (n=854). In der Tafamidis Gruppe wurden unterschiedliche Dosierungen verwendet. Die meisten (77,5 %) erhielten eine hohe Dosis Tafamidis (80 mg/61 mg), während ein kleiner Teil mit 20 mg Tafamidis behandelt wurde, die es entweder durchgängig (8,9 %) erhielten oder danach auf eine hohe Dosis Tafamidis umgestellt wurden (12,4 %).
- ⮚ Überlebensrate nimmt mit der Zeit zu
Eine Sensitivitätsanalyse, die Patient:innen vor und nach 2019 miteinander verglich, zeigte zudem, dass die Überlebensraten im Laufe der Zeit zunahmen. Ihr zufolge wiesen Patient:innen, die nach 2018 in THAOS aufgenommen wurden, nach 30 und 42 Monaten unter Tafamidis 61 mg Überlebensraten von 87,3 % (82,6–90,8) und 82,8 % (75,7–87,9) auf vs. 77,2 % (69,8–83,1) und 67,3 % (56,9–75,8) bei Patient:innen, die den Transthyretin-Stabilisator nicht erhielten.2
- ⮚ Sicherheit der Therapie bestätigt
Es wurden keine neuen Sicherheitssignale bei THAOS-Patient:innen identifiziert, die mit Tafamidis 61 mg behandelt wurden.2 Therapiebedingte Nebenwirkungen traten unter Tafamidis 61 mg bei 27,4 % der Teilnehmenden auf. Die TEAE-Rate lag damit in der Real-World-Studie numerisch niedriger als in der klinischen Studie ATTR-ACT.2,3
Limitationen der THAOS Real-World-Studie2
- Bei dieser Studie handelt es sich um ein Beobachtungsregister, das nicht immer vollständige Daten enthält, und nicht für alle Patient:innen lagen Baseline-Daten vor
- Aufgrund des Beobachtungscharakters dieser Studie waren statistische Verzerrungen nicht auszuschließen (z. B. Selektionsverzerrung, Stichprobenverzerrung und zeitliche* Verzerrung)
- Die mediane Nachbeobachtungszeit belief sich in beiden Gruppen auf 2 Jahre, was die Zuverlässigkeit der Überlebensanalysen in späteren Monaten begrenzt
- Die geringen Patient:innenzahlen mit TTR-Genotyp-Varianten lassen keine zuverlässigen Rückschlüsse auf das Überleben in Genotyp-Untergruppen zu
- Es liegen keine Daten zum Einsatz der SPECT-Bildgebung bei Patient:innen vor, die mittels Szintigraphie diagnostiziert wurden.
- Daher sind Fehldiagnosen möglich, da eine Szintigraphie ohne SPECT zu falsch positiven Ergebnissen führen kann
Hier können Sie die Originalpublikation lesen
* Die zugelassene Formulierung mit 61 mg Tafamidis entspricht 80 mg Tafamidis-Meglumin 5
§ Das THAOS-Register (Transthyretin Amyloidosis Outcomes Survey) ist eine globale, longitudinale, nicht-interventionelle Phase IV- Studie, die 6718 Personen mit Transthyretin-Amyloidose oder asymptomatischer Trägerschaft von TTR-Mutationen beobachtet. 1441 der Personen im Register waren ATTR-CM-Patient:innen aus 18 Ländern mit einem vorwiegend kardialen Phänotyp, die entweder keine Behandlung erhielten oder mit VYNDAQEL®; behandelt wurden.2
# Beobachtungsstudien haben ein hohes Verzerrungspotenzial, rein explorativen Charakter und können keine Kausalität nachweisen. Zu den Limitationen dieser Registerstudie zählen eine relativ kurze mediane Nachbeobachtungszeit von 2 Jahren in beiden Gruppen, eine geringe Anzahl von Patient:innen mit TTR-Genotyp-Varianten, die keine zuverlässigen Rückschlüsse auf das Überleben in Genotyp-Subgruppen zulassen sowie wie aufgrund des Studiendesigns als Registerstudie fehlende Daten bei individuellen Patient:innen.