Was macht CLL-Patient:innen zu Hochrisiko-Patient:innen?
Die Testung auf molekulare Risikofaktoren vor Beginn einer CLL-Therapie ist ein Muss. Wird ein Hochrisiko-Status ermittelt, kommen nach den Onkopedia-Leitlinien nur zielgerichtete Therapien für die Behandlung infrage.
Kernpunkte:
- Bei der Therapiewahl für CLL-Patient:innen spielen heute tumorgenetische Risikomerkmale und deren (wiederholte) Testung vor Beginn einer Erstlinien- bzw. einer Rezidivtherapie eine zentrale Rolle.
- Die Mehrheit der CLL-Patient:innen weist mindestens einen von vier therapeutisch relevanten Risikofaktoren auf.
- Für den Zweitgenerations-Bruton-Tyrosinkinase-Inhibitor Acalabrutinib ist eine starke PFS-Wirksamkeit über alle Risikogruppen hinweg – auch für Hoch- und Höchstrisikopatient:innen – belegt.
- Aufgrund seiner guten Verträglichkeit ist Acalabrutinib für eine Dauertherapie geeignet.
Fallbeispiel mit Fragen:
Bei einer 66-jährigen Frau wird im März 2019 die Diagnose einer chronischen lymphatischen Leukämie (CLL) im Stadium Binet A gestellt. Diese bleibt zunächst unbehandelt, bis es im Oktober 2020 zu einem deutlichen Leistungsabfall der Patientin kommt. Die Laborkontrolle ergibt einen Hb-Wert von 9,3 g/dl und eine Thrombozytenzahl von 78 / nl.
Antwort:
Die seit September 2020 gültige Version der Onkopedia-Leitlinie zur CLL empfiehlt vor Einleitung einer Therapie die Durchführung einer molekularen Zytogenetik bezüglich folgender vier Risikomerkmale:1
- 17p-Deletion;
-
TP53-Mutation;
- unmutierter IGHV-Status;
- komplexer Karyotyp.
Das Vorgehen in der klinischen Praxis erläutert der Leitlinien-Erstautor Prof. Clemens Wendtner (München) hier im Kurzinterview.
Der zytogenetische Befund lautet:
- keine 17p-Deletion;
- keine TP53-Mutation;
- unmutierter IGHV-Status;
- kein komplexer Karyotyp.
Antwort:
Ja, da bereits das Vorliegen eines dieser vier Risikomerkmale – in diesem Fall der unmutierte IGHV-Status – eine prognostische Hochrisiko-Situation darstellt, mit der eine niedrigere Ansprechrate und ein kürzeres progressionsfreies Überleben sowie Gesamtüberleben nach Chemoimmuntherapie assoziiert sind.1
Befundzusammenfassung:
- Alter > 65 Jahre, ECOG-Status 0;
- Binet C;
- Beta-2-Mikroglobulin > 3,5 mg/L;
- unmutierter IGHV-Status;
- keine Chromosom 17p-Deletion oder TP53-Mutation.
Antwort:
„Patient:innen mit diesen Risikofaktoren sollten heute keine Chemoimmuntherapie mehr bekommen, sondern zielgerichteten Therapien zugeführt werden, also einer Therapie mit einem Bruton-Tyrosinkinase-Inhibitor (BTKi) mit oder ohne Anti-CD20-Antikörper oder einer Therapie mit dem BCL-2-Inhibitor Venetoclax plus dem Anti-CD-20-Antikörper Obinutuzumab“, so Prof. Wendtner im Interview.
Hochrisiko-Status: klinisch relevant und häufig
Mit dem Einzug der zielgerichteten Therapien haben molekulare Biomarker eine zentrale Bedeutung für das CLL-Behandlungsmanagement erlangt, was auch in ihrer übergeordneten Stellung in den Therapiestrukturen der aktuellen Leitlinien sowohl für die Erstlinie als auch bei Rezidiv/Refraktärität zum Ausdruck kommt.1,2 Der Grund dafür ist die profunde Evidenz, mit der zum einen die Häufigkeit dieser Risikofaktoren belegt ist und zum anderen ihre prognostische Aussagekraft bezüglich des verkürzten Überlebens bzw. der verminderten Wirksamkeit unter einer Chemoimmuntherapie.3-10
Empfehlungen zur Biomarker-Diagnostik bei CLL
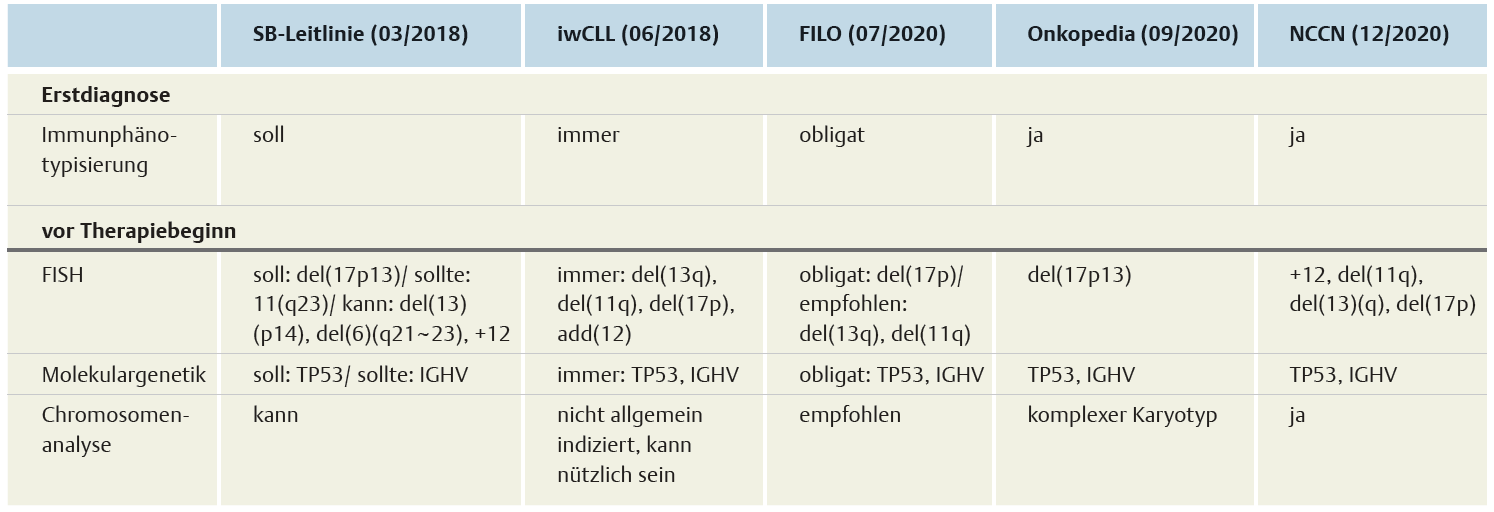
Abb. 1: Aktuelle Leitlinienempfehlungen zur Biomarker-Diagnostik bei CLL-Patient:innen bei Erstdiagnose und Therapiebeginn.1,2,11-13
Mehrheit der CLL-Patient:innen hat Hochrisiko-Status
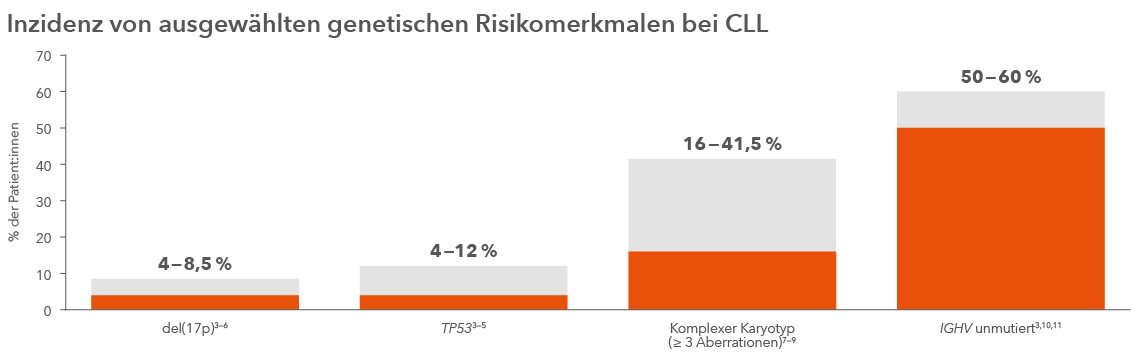
Abb. 2: Die Mehrheit der CLL-Patient:innen weist bei Diagnose genetische Hochrisiko-Merkmale auf (adaptiert nach: siehe Legende).
*Die Balken beschreiben die Bereiche der Inzidenzraten der ausgewählten genetischen Hochrisiko-Merkmale.
Abb. 2 wurde adaptiert nach: 1. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) für CLL/SLL. V.4.2020. © National Comprehensive Cancer Network, Inc. 2019. Alle Rechte vorbehalten. Letzter Zugriff 01.08.20. Die aktuelle und vollständige Version der Guideline ist online zu finden unter NCCN.org.
Referenzen:
3. International CLL-IPI Working Group. Lancet Oncol. 2016;17:779-790 (und Supplement).
4. Campo E et al. Haematologica. 2018;103:1956-1968.
5. Stilgenbauer S et al. Blood. 2008;112:2089.
6. Grever MR et al. J Clin Oncol. 2007;25:799-804.
7. Baliakas P et al. Am J Hematol 2014;89:249-255.
8. Sharman JP et al. Lancet. 2020;395:1278-1291.
9. Ghia P et al. J Clin Oncol. 2020;38:2849-2861.
10. Delgado et al. Am J Hematol. 2017;92:375-380.
11. International CLL-IPI Working Group. Lancet Oncol. 2016;17:779-790.
Hochrisiko-Patient:innen haben eine schlechtere Prognose

Abb. 3: Patient:innen mit genetischen Hochrisiko-Merkmalen haben schlechtere Therapieergebnisse (überwiegend mit CIT behandelt).14
CIT = Chemoimmuntherapie; NE = Nicht evaluierbar; NR = Nicht erreicht, OS = Gesamtüberleben; RTK = Rezeptor-Tyrosinkinase; TN = Behandlungsnaiv
*Unter den Patient:innen, die in die Mayo-Kohorte eingeschlossen waren (N=838), die eine Erstlinientherapie erhielten (N=326): Purinanalogon-basierte Chemoimmuntherapie (50%), Purinanalogon-Monotherapie oder in Kombination ohne einen monoklonalen Antikörper (1,5%), Alkylans-basierte Chemoimmuntherapie (11,3%), Alkylans-Monotherapie oder Kombination ohne einen monoklonalen Antikörper (3,4%), nur Antikörper (29,8%), RTK-Inhibitoren (2,1%), andere (1,8%)14
Für Hochrisiko-Patient:innen haben sich mit den zielgerichteten Therapien die Chancen auf gute Behandlungsergebnisse deutlich verbessert. Die Onkopedia-Leitlinie empfiehlt auch bei komorbiden Patient:innen ohne genetische Risikofaktoren vorrangig eine Therapie mit BTKi – wahlweise mit oder ohne Anti-CD20-Antikörper – oder alternativ die Kombinationstherapie mit dem BCL-2-Inhibitor Venetoclax plus Anti-CD20-AK . Die orale BTKi-Monotherapie stellt einen in Pandemie-Zeiten vorteilhaften und leitliniengerechten Standard über alle Indikationssegmente der CLL dar.1,2
Deutlich verbessertes PFS unter Acalabrutinib auch bei Hochrisiko-Patient:innen
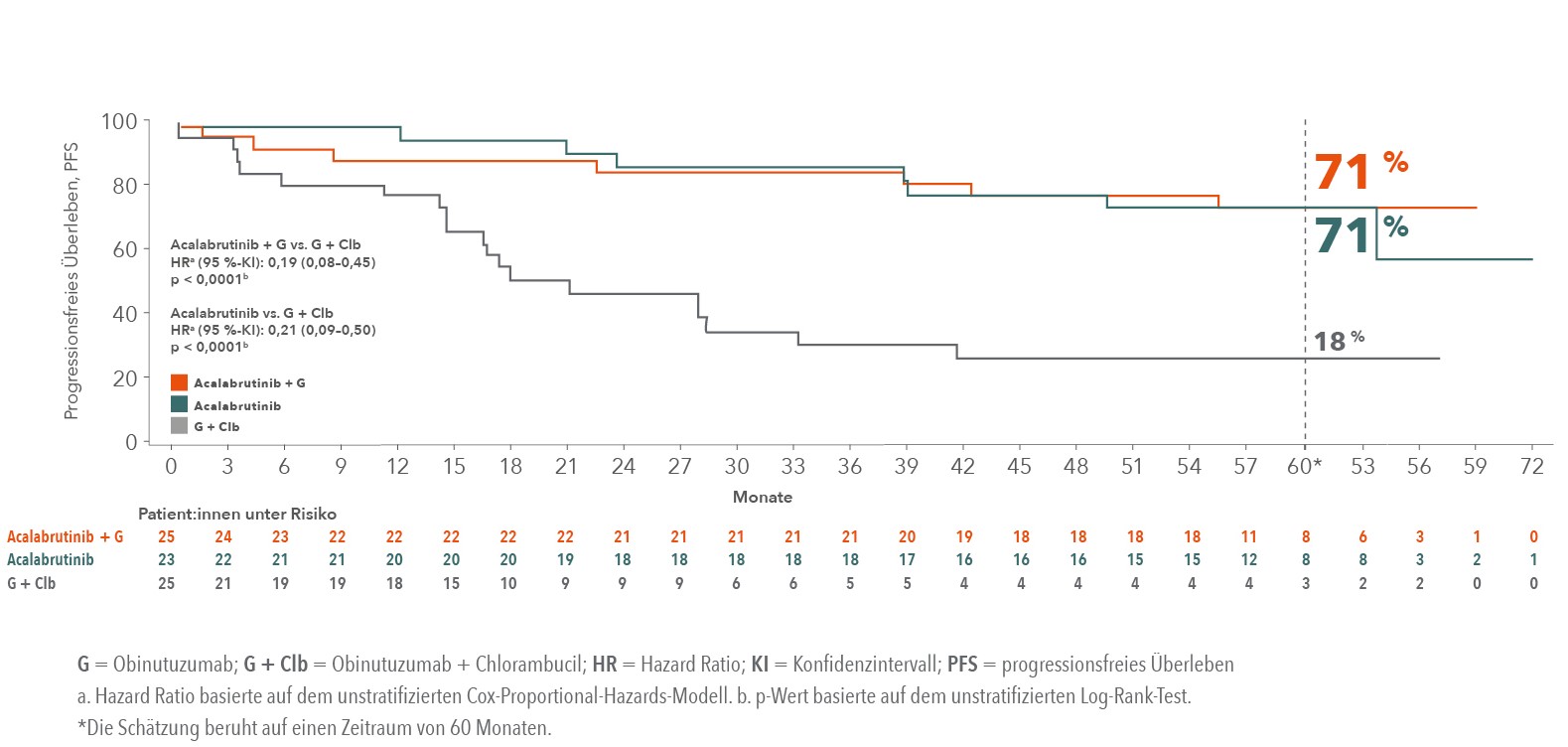
Abb. 4: PFS-Kurve unter Acalabrutinib bei therapienaiven Patient:innen mit TP53-Mutation/17p-Deletion.15
Erneutes Testen im Fall eines Rezidivs erforderlich
„Wichtig: Wenn es zu einem Rezidiv trotz dieser sehr effektiven Therapien kommt, sollten diese molekulargenetischen Faktoren erneut bestimmt werden“, so Prof. Wendtner. Aufgrund der Möglichkeit einer klonalen Evolution können sich die Marker im zeitlichen Verlauf verändern. Lediglich der IGHV-Status bleibt unverändert und bedarf keiner wiederholten Überprüfung.
Mehr Verträglichkeit mit Acalabrutinib
Mit Acalabrutinib (Calquence®) steht in der Nachfolge von Ibrutinib, dem ersten Substanzklassenvertreter, ein BTKi mit erhöhter Selektivität und optimiertem Nebenwirkungsprofil zur Verfügung.1,16 In den zulassungsrelevanten Phase-III-Studien profitierten sowohl therapienaive Patient:innen (ELEVATE TN15) als auch Patient:innen mit refraktärer/rezidivierter CLL (ASCEND17) über alle vordefinierten Subgruppen hinweg durch ein deutlich verlängertes PFS gegenüber der jeweiligen Vergleichstherapie.
Acalabrutinib hat sich hierzulande bereits im ersten Jahr nach seiner EMA-Zulassung im November 2020 als ein neuer Therapiestandard bei therapienaiven und vorbehandelten Patient:innen mit CLL etabliert. „Insgesamt kann man zusammenfassen, dass Acalabrutinib eine sehr effektive Therapie ist, und die schließt eben auch CLL-Patient:innen mit Hochrisiko und Höchstrisiko ein“, so Prof. Wendtner.
- Wendtner CM et al. Onkopedia-Leitlinie Chronische Lymphatische Leukämie (CLL). Stand: September 2020
- NCCN Clinical Practice Guidelines in Oncology. Chronic Lymphocytic Leukemia/Small Lymphocytic Lymphoma. Version 2.2022 — January 18, 2022
- Hallek M, Al-Sawaf O. Chronic lymphocytic leukemia: 2022 update on diagnostic and therapeutic procedures. Am J Hematol 2021;96(12):1679-705
- Kay NE et al. CLL update 2022: A continuing evolution in care. Blood Reviews 2022;100932
- Zenz T et al. TP53 mutation and survival in chronic lymphocytic leukemia. J Clin Oncol 2010;28:4473-9
- Claus R, Pfannes W. Neuer Blickwinkel auf die Biologie des IGHV-Mutationsstatus bei der CLL. Karger Kompass Onkol 2019;6:102-3
- Damle RN et al. Ig V gene mutation status and CD38 expression as novel prognostic indicators in chronic lymphocytic leukemia Blood 1999;94:1840-7
- Hamblin TJ et al. Unmutated Ig VH Genes Are Associated With a More Aggressive Form of Chronic Lymphocytic Leukemia. Blood 1999;94:1848-54
- Cohen JA et al. An Updated Perspective on Current Prognostic and Predictive Biomarkers in Chronic Lymphocytic Leukemia in the Context of Chemoimmunotherapy and Novel Targeted Therapy. Cancers 2020;12:894
- Baliakas P et al. Cytogenetic complexity in chronic lymphocytic leukemia: definitions, associations, and clinical impact. Blood 2019;133:1205-16
- S3-Leitlinie zur Diagnostik, Therapie und Nachsorge für Patienten mit einer chronischen
lymphatischen Leukämie (CLL). Langversion 1.0 – März 2018. AWMF-Registernummer: 018-032OL
- Hallek M et al. iwCLL guidelines for diagnosis, indications for treatment, response assessment, and supportive management of CLL. Blood 2018;131:2745-60
- Quinquenel A et al. Diagnosis and Treatment of Chronic Lymphocytic Leukemia: Recommendations of the French CLL Study Group (FILO). Hemasphere 2020;4:e473
- International CLL-IPI working group. An international prognostic index for patients with chronic lymphocytic leukaemia (CLL-IPI): a meta-analysis of individual patient data. Lancet Oncol 2016;17(6):779-90
- Sharman JP et al. Acalabrutinib ± Obinutuzumab vs Obinutuzumab + Chlorambucil in Treatment-Naive Chronic Lymphocytic Leukemia: 5-Year Follow-Up of ELEVATE-TN Präsentiert anlässlich des American Society of Clinical Oncology (ASCO) Annual Meeting; 3.-7. Juni 2022, Chicago/Illinois, USA. Poster 7539.
- Fachinformation Calquence®; Stand: November 2021
- Ghia P et al. ASCEND: Phase III, Randomized Trial of Acalabrutinib Versus Idelalisib Plus Rituximab or Bendamustine Plus Rituximab in Relapsed or Refractory Chronic Lymphocytic Leukemia. J Clin Oncol 2020;38(25):2849-61



