BTK-Inhibitor der nächsten Generation: Welche Rolle spielt die Selektivität für die Praxis?
Der Unterschied zwischen den verfügbaren Bruton-Tyrosinkinase-Inhibitoren der ersten und nächsten Generation liegt maßgeblich in ihrer Selektivität. Diese beeinflusst die Verträglichkeit und damit die Erfolgschancen der Therapie.
Kernpunkte:
- Die Ergebnisse der ELEVATE-RR-Studie geben Hinweise auf einen möglichen Zusammenhang zwischen der Selektivität der BTKi in vitro und dem Nebenwirkungsprofil in vivo.
- Der Wirkstoff Acalabrutinib, der in vitro die höchste Selektivität aufweist, zeigt in klinischen Studien eine gute Verträglichkeit. Die Ergebnisse der ELEVATE-RR-Studie belegen diesbezügliche Vorteile für Acalabrutinib versus Ibrutinib im direkten Vergleich.
- Unter diesem Aspekt kann der BTKi der nächsten Generation verbesserte Möglichkeiten für eine CLL-Dauertherapie bieten.
Das therapeutische Management bei der chronischen lymphatischen Leukämie (CLL) wird heute durch zielgerichtete Therapien dominiert, während die Chemoimmuntherapie an Bedeutung verloren hat. Dabei nimmt die Inhibition der Bruton-Tyrosinkinase (BTK) einen zentralen Stellenwert ein. BTK-Inhibitoren (BTKi) werden in der aktuellen Onkopedia-Leitlinie durchgängig über alle Indikationssegmente hinweg als Standardtherapie empfohlen.1
Häufiger Therapieabbruch unter Ibrutinib
Dem Einsatz von Ibrutinib, dem BTKi der ersten Generation, sind trotz der vielversprechenden Ergebnisse Grenzen durch sein Toxizitätsprofil gesteckt. Insgesamt spricht die Real-World-Evidenz dafür, dass es im Praxisalltag häufiger als in randomisierten klinischen Studien zum nebenwirkungsbedingten Absetzen von Ibrutinib kommt. Bis zu 50 % der Patient:innen brechen eine Ibrutinib-Therapie im realen Behandlungsgeschehen vorzeitig ab, am häufigsten (bis zu 56 %) aufgrund von toxischen Nebenwirkungen.2-6 In einer großen retrospektiven Analyse endete eine Behandlung mit Ibrutinib bei 41 % der Patient:innen nach einer medianen Dauer von 7 Monaten vorzeitig, hauptsächlich aufgrund von Unverträglichkeiten.4
Seit Ende 2020 steht mit Acalabrutinib ein BTKi der nächsten Generation für Patient:innen mit zuvor unbehandelter oder behandelter CLL zur Verfügung.7 Neben Ibrutinib und Acalabrutinib wird mit Zanubrutinib bald auch noch ein dritter BTKi zur Verfügung stehen. Diese Substanzen haben zwar alle den gleichen Wirkmechanismus, unterscheiden sich aber in ihrer Verträglichkeit, was u. a. mit ihrer Selektivität zusammenhängen kann.8
BTKi der 1. und nächsten Generation: Unterschiede im selektiven Bindungsverhalten
Die BTK gehört zu den Tyrosinkinasen der Tec-Familie und wird in B-Lymphozyten, Knochenmark- und Mastzellen sowie Thrombozyten exprimiert. Als zentrale Komponente des B-Zell-Rezeptor-Signalwegs spielt die BTK für die Proliferation und das Überleben der Zellen eine essenzielle Rolle. Sowohl Ibrutinib als auch Acalabrutinib binden kovalent an das aktive Zentrum der Kinase, was zu einer anhaltenden Hemmung ihrer enzymatischen Aktivität führt.9
Im selektiven Bindungsverhalten der verschiedenen BTKi finden sich in vitro allerdings relevante Unterschiede: Während Ibrutinib und auch Zanubrutinib neben der BTK eine Reihe von weiteren Kinasen inhibieren, ist das beim hochselektiven Acalabrutinib nur in einem sehr geringen Ausmaß der Fall.10
Acalabrutinib: höchste Selektivität in vitro
Tatsächlich zeigt sich Acalabrutinib in vitro bei einer Wirkstoffkonzentration von 1 µM als der selektivste BTKi unter denjenigen Präparaten, die gegenwärtig oder in naher Zukunft für den therapeutischen Einsatz bei CLL infrage kommen.11 Dabei weist auch der aktive Hauptmetabolit von Acalabrutinib (ACP-5862/M27) eine ähnliche Selektivität wie die Grundsubstanz auf.11,12
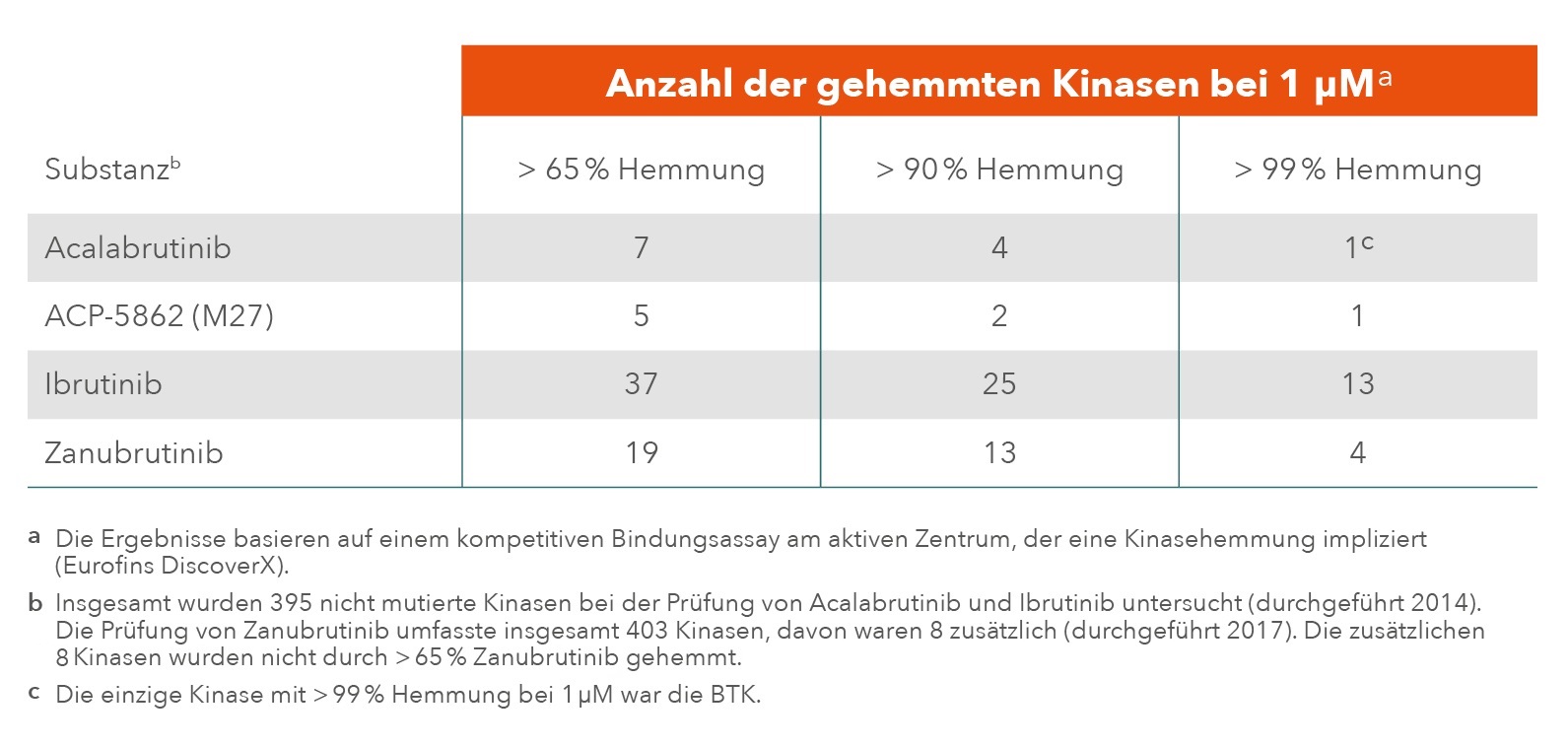 Nur für den BTKi Acalabrutinib gilt: Die stärkste Wirksamkeit (Hemmung > 99 %) beschränkt sich allein auf die BTK.11,12
Nur für den BTKi Acalabrutinib gilt: Die stärkste Wirksamkeit (Hemmung > 99 %) beschränkt sich allein auf die BTK.11,12
Um mit den In-vitro-Ergebnissen wirklich etwas anfangen zu können, muss allerdings sichergestellt sein, dass die Selektivitätsmessungen bei einer Wirkstoffkonzentration erfolgen, die der therapeutischen Realität entspricht. Ex-vivo-Untersuchungen zur BTKi-Konzentration in Patient:innenplasma belegen das mit den folgenden Messwerten:
- Ibrutinib: 0,5 µM13
- Acalabrutinib: 1,3 µM14
- Zanubrutinib: 1,4 µM15
Die im Assay zur Kinomprofilbestimmung verwendete Wirkstoffkonzentration von 1 µM (siehe Grafik oben) liegt demzufolge bei allen drei Substanzen im therapeutischen Bereich.
Was bedeutet eine höhere Unspezifität?
Die therapeutische Relevanz der Untersuchungen auf (Un-)Spezifität der verschiedenen BTKi liegt auf der Hand: Nebenwirkungen können durch On-Target- oder durch Off-Target-Effekte bedingt sein. Im Gegensatz zu On-Target-Effekten, die durch die spezifische Hemmung der BTK (= Target) bedingt sind, lassen sich Off-Target-Effekte, die aus der Hemmung biologisch verwandter Kinasen oder in keinem Zusammenhang mit dem Target stehenden Kinasen resultieren, durch eine höhere BTKi-Spezifität vermeiden.
So spielen etwa Off-Target-Effekte, die u. a. die T-Zell-Aktivierung, die EGFR-Aktivierung von Epidermalzellen und die Zytotoxizität von NK-Zellen betreffen, unter Acalabrutinib im Gegensatz zu Ibrutinib kaum eine Rolle.9,10,16
Zu den unter Ibrutinib beobachteten Nebenwirkungen, die durch die Inhibition von Off-Target-Kinasen erklärt werden können, zählen etwa das erhöhte Risiko für Vorhofflimmern (via Src), Blutungen (via TEK, ITK), Rash und Diarrhö (via EGFR).9,16,17-21
|
Off-Target-Kinase
|
Möglicher Zusammenhang mit unerwünschten Ereignissen bei Hemmung der jeweiligen Kinase (In-vitro-Daten)9,16,17-21*
|
|
EGFR
|
Hautausschlag, Diarrhö (vermutlich Klasseneffekte)
|
|
ITK
|
Minderung der antikörperabhängigen zellulären Zytotoxizität von NK-Zellen, Reduktion der TH17-T-Zellen
|
|
TXK
|
Einfluss auf das Verhältnis von TH17/Treg-Zellen
|
|
TEC
|
Blutungen
|
|
Kinasen der Src-Familie
|
Blutungen (LCK, SRC) und Vorhofflimmern (CSK)
|
*Die klinische Relevanz dieser Zusammenhänge bedarf noch einer weiteren Bestätigung durch klinische Studien (ergänzte Zusammenstellung nach Stilgenbauer 20208).
Off-Target-Effekte beeinflussen das Verträglichkeitsprofil
Die Erforschung der pharmakokinetischen Eigenschaften von Acalabrutinib erfolgte in verschiedenen Tiermodellen und an menschlichem Gewebe. Die hochselektive Qualität des BTKi der nächsten Generation wurde dabei u. a. durch zwei Beobachtungen bestätigt: durch anhaltende Gefäßwand-Interaktionen von Thrombozyten-Isolaten (die unter Ibrutinib-Behandlung signifikant reduziert waren) und durch die intakte NK-Zell-vermittelte Zytotoxizität im peripheren Blut von Acalabrutinib-behandelten Patient:innen.9,22
Für die Behandlungspraxis ist wichtig: Die kurze Plasma-Halbwertszeit und die hohe Selektivität von Acalabrutinib ermöglichen bei zweimal täglicher Einnahme eine nahezu komplette und kontinuierliche BTK-Inhibition von ≥ 95 % über 24 Stunden ohne gesteigerte Toxizität.14
Seine Überlegenheit im Vergleich zum BTKi der ersten Generation konnte Acalabrutinib im direkten Head-to-Head-Vergleich im Rahmen der randomisierten, offenen Phase-III-Studie ELEVATE RR unter Beweis stellen: Bei Nicht-Unterlegenheit hinsichtlich der Wirksamkeit zeigte Acalabrutinib ein günstiges Verträglichkeitsprofil mit signifikant niedrigeren Raten von Diarrhö, Arthralgie, Harnwegsinfektionen, Rückenschmerzen, Muskelkrämpfen und Dyspepsie im Vergleich mit Ibrutinib. Auch die Raten von kardiovaskulären Nebenwirkungen wie Vorhofflimmern, Hypertension und Blutungen waren geringer, was insbesondere bei älteren Patient:innen eine Rolle spielen kann. Kopfschmerzen (alle Grade), Husten (alle Grade) sowie Müdigkeit (Grad ≥ 3) traten unter Acalabrutinib im Vergleich zu Ibrutinib häufiger auf. Diese Unterschiede haben praktische Relevanz: Unter Acalabrutinib brachen weniger Patient:innen ihre Therapie aufgrund von Nebenwirkungen ab.23
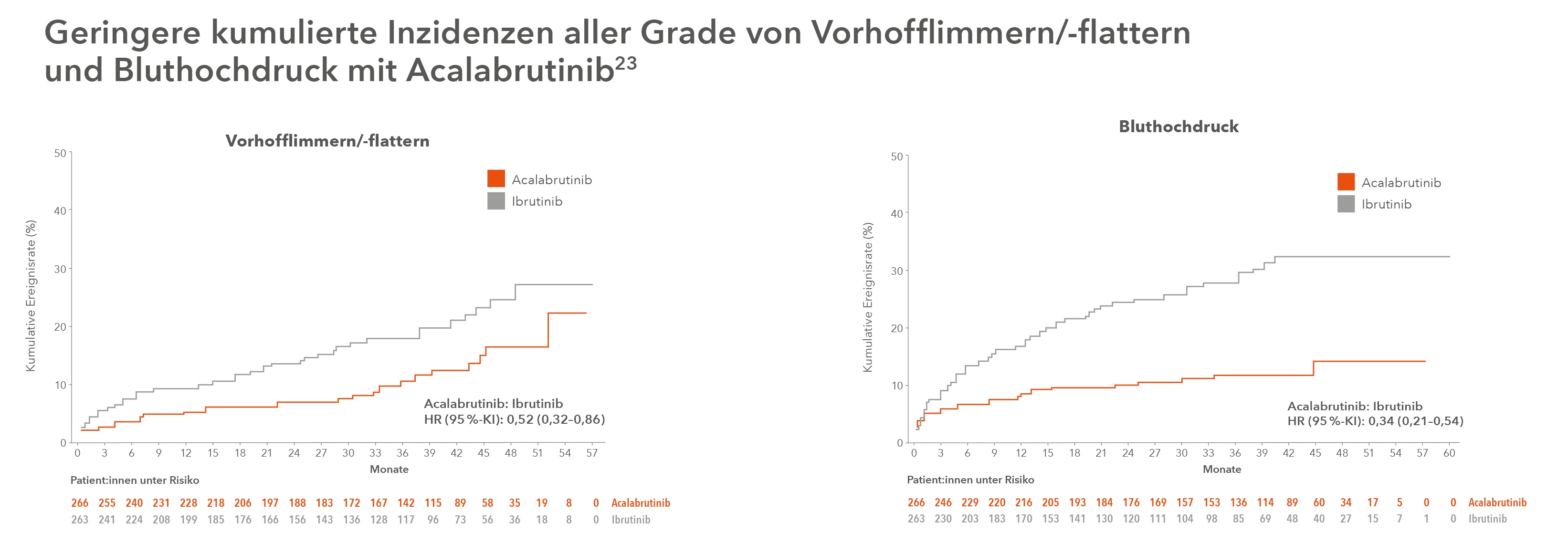
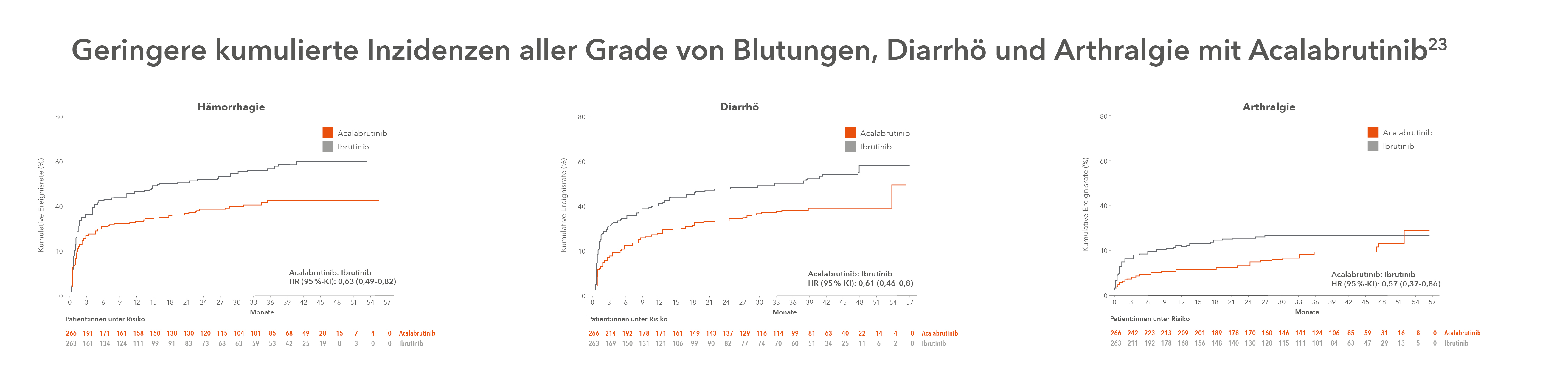
Aktuelle Daten bestätigen Vorteile bei der kardiovaskulären Sicherheit
Zwei im Jahr 2019 publizierte Studienergebnisse belegen eine hohe Ansprechrate und gute Verträglichkeit bei Ibrutinib-intoleranten CLL-Patient:innen nach Umstellung auf Acalabrutinib.24,25 Bei der ASH-Tagung 2020 präsentierte Daten untermauern die Vorteile des BTKi der nächsten Generation hinsichtlich der kardiovaskulären Verträglichkeit. Im Rahmen einer gepoolten Analyse von vier Studien zur Acalabrutinib-Monotherapie traten kardiale Ereignisse aller Grade bei 17 % der Patient:innen auf und machten bei 1 % einen Therapieabbruch erforderlich.26 Mit einer Inzidenz von 4 % war Vorhofflimmern in etwa so häufig zu beobachten wie in der Allgemeinbevölkerung. Zudem bescheinigt eine Network-Metaanalyse Acalabrutinib ein verbessertes Sicherheitsprofil mit geringeren Raten an Anämien, Thrombozytopenien und kardiovaskulären Nebenwirkungen als unter Ibrutinib.27
Besondere Relevanz in Pandemie-Zeiten
Unter den Bedingungen der COVID-19-Pandemie ist weiterhin und erst recht ein leitliniengerechtes CLL-Management anzustreben, da die Tumorkontrolle auch der Infektkontrolle dient.28 Expertenempfehlungen fokussieren dabei auf die BTKi-Monotherapie, die oral appliziert wird und im Regelfall weniger engmaschige Kontrollen efordert.29 Da es für den Erfolg einer oralen Krebstherapie auf eine hohe Therapieadhärenz ankommt, sind die Verträglichkeitsvorteile von Acalabrutinib gegenüber Ibrutinib bei gleicher Wirksamkeit im aktuellen Behandlungsalltag umso relevanter.
- Wendtner CM et al. Onkopedia-Leitlinie Chronische Lymphatische Leukämie (CLL); Stand: September 2020
- Sharman JP et al. Understanding Ibrutinib Treatment Discontinuation Patterns for Chronic Lymphocytic Leukemia. Blood 2017;130:4060 (ASH Abstr)
- Jain P et al. Long-term outcomes for patients with chronic lymphocytic leukemia who discontinue Ibrutinib. Cancer 2017;123(12):2268-73
- Mato AR et al. Toxicities and outcomes of 616 ibrutinib-treated patients in the United States: a real-world analysis. Haematologica 2018;103: 874-9
- Mato AR et al. Outcomes of front-line ibrutinib treated CLL patients excluded from landmark clinical trial. Am J Hematol 2018;93(11):1394-401
- Hampel PJ et al. Rapid disease progression following discontinuation of ibrutinib in patients with chronic lymphocytic leukemia treated in routine clinical practice. Leuk Lymphoma 2019;60(11):2712-9
- Fachinformation Calquence®; Stand: November 2021
- Stilgenbauer S. Zielgerichtete Therapieoptionen bei chronischer lymphatischer Leukämie (CLL) in 2020. (cme.medlearning.de; Zugriff am 03.05.2022)
- Barf T et al. Acalabrutinib (ACP-196): A Covalent Bruton Tyrosine Kinase Inhibitor with a Differentiated Selectivity and In Vivo Potency Profile. J Pharmacol Exp Ther 2017;363:240-52
- Kaptein A et al. Potency and Selectivity of BTK Inhibitors in Clinical Development for B-Cell Malignancies. Blood 2018;132(Suppl_):1871
- Kaptein A et al. Preclinical pharmacological profiling of ACP-5862, the major metabolite of the covalent BTK inhibitor acalabrutinib, displays intrinsic BTK inhibitory activity. Cancer Res 2019;79(13_Suppl):2194
- EPAR: https://www.ema.europa.eu/en/documents/assessment-report/calquence-epar-public-assessment-report_en.pdf
- Nicolson PLR et al. Inhibition of Btk by Btk-specific concentrations of ibrutinib and acalabrutinib delays but does not block platelet aggregation mediated by glycoprotein VI. Haematologica 2018;103(12): 2097-108
- Byrd JC et al. Acalabrutinib (ACP-196) in relapsed chronic lymphocytic leukemia. N Engl J Med 2016;374:323-32
- Liu Z et al. Distinct BTK inhibitors differentially induce apoptosis but similarly suppress chemotaxis and lipid accumulation in mantle cell lymphoma. BMC Cancer 2021;21(1):732
- Herman SEM et al. The Bruton’s tyrosine kinase (BTK) inhibitor acalabrutinib demonstrates potent on-target effects and efficacy in two mouse models of chronic lymphocytic leukemia. Clin Cancer Res 2017;23(11):2831-41
- Lipsky AH et al. Incidence and risk factors of bleeding-related adverse events in patients with chronic lymphocytic leukemia treated with ibrutinib. Haematologica 2015;100:1571
- Brown JR. How I treat CLL patients with ibrutinib. Blood 2018;131:379-86
- Wang A et al. Ibrutinib targets mutant-EGFR kinase with a distinct binding conformation. Oncotarget 2016;7:69760-9
- Fakhri B, Andreadis C. The role of acalabrutinib in adults with chronic lymphocytic leukemia. Ther Adv Hematol 2021;12:2040620721990553
- Xiao L et al. Ibrutinib-Mediated Atrial Fibrillation Attributable to Inhibition of C-Terminal Src Kinase. Circulation 2020;142(25):2443-55
- Delgado J et al. EMA Review of Acalabrutinib for the Treatment of Adult Patients with Chronic Lymphocytic Leukemia. Oncologist 2021;26(3):242-9
- Byrd JC et al. Acalabrutinib Versus Ibrutinib in Previously Treated Chronic Lymphocytic Leukemia: Results of the First Randomized Phase III Trial. J Clin Oncol 2021;39(31):3441-52
- Awan FT et al. Acalabrutinib monotherapy in patients with chronic lymphocytic leukemia who are intolerant to Ibrutinib. Blood Adv 2019;3(9):1553-62
- Rogers K et al. Phase 2 study of acalabrutinib in ibrutinib (IBR)-intolerant patients (pts) with relapsed/refractory (R/R) chronic lymphocytic leukemia (CLL). J Clin Oncol 2019;37(15_suppl):7530
- Brown JR et al. Cardiovascular adverse events in patients with chronic lymphocytic leukemia receiving acalabrutinib monotherapy: pooled analysis of 762 patients. Haematologica 2022;107(6):1335-46
- Hilal T et al. Adverse Events in Clinical Trials of Ibrutinib and Acalabrutinib for B-Cell Lymphoproliferative Disorders: A Systematic Review and Network Meta-Analysis. ASH 2020, Abstract 1317
- DGHO. Empfehlungen zur COVID-19-Schutzimpfung bei Patienten mit Blut-und Krebserkrankungen. 17.12.2020 (PDF-Link)
- Stern V. Experts Offer Roadmap for Treating CLL During the Pandemic. Medscape, December 23,2020. (medscape.com; Zugriff am 22.02.2020)
Abkürzungen:
ASH = American Society of Hematology
BTKi = Bruton-Tyrosinkinase-Inhibitor
CLL = Chronische lymphatische Leukämie
DGHO = Deutsche Gesellschaft für Hämatologie und Medizinische Onkologie
EGFR = Epidermal Growth Factor Receptor (Rezeptor-Tyrosinkinase)
ITK = Interleukin-2-induzierbare T-Zell-Kinase
 Nur für den BTKi Acalabrutinib gilt: Die stärkste Wirksamkeit (Hemmung > 99 %) beschränkt sich allein auf die BTK.11,12
Nur für den BTKi Acalabrutinib gilt: Die stärkste Wirksamkeit (Hemmung > 99 %) beschränkt sich allein auf die BTK.11,12

