- Wendtner CM et al. Onkopedia-Leitlinie. Online verfügbar unter https://www.onkopedia.com/de/onkopedia/guidelines/chronischelymphatische-leukaemie-cll/@@guideline/html/index.html (Stand: September 2020).
- Eichhorst B et al. Ann Oncol. 2015;26(suppl 5):v78-v84.
- Lymphoma Coalition. https://www.lymphomacoalition.org/images/subtype-reports/CLL_Global_2017_Report.pdf (letzter Zugriff: Oktober 2020).
- Strati P et al. Br J Haematol. 2017;178(3):394-402.
- Gordon MJ et al. Cancer 2018;124(15):3192-3200.
- Goede V et al. Haematologica 2014;99(6):1095-100.
- Reyes C et al. Blood (2012) 120 (21): 758.
- Thurmes P et al. Leuk Lymphoma. 2008;49:49-56.
- Rigolin GM et al. Blood. 2017;129:3495-3498.
- Eichhorst B et al. Blood 2014;124 (21):19.
- Sharman JP, et al. Lancet. 2020;395:1278-1291.
- Ghia P, et al. J Clin Oncol. 2020;38(25):2849-2861.
- Fachinformation CALQUENCE®, Stand: November 2020.
- S3-Leitlinie zur Diagnostik, Therapie und Nachsorge für Patienten mit einerchronischen lymphatischen Leukämie(CLL). Online verfügbar unter https://www.awmf.org/uploads/tx_szleitlinien_018-032OLl_S3_Chronisch-lymphatische-Leukaemie_2018-04.pdf (letzter Zugriff: 24.10.2020).
- Reda G et al. J Hematol Oncol 2018; 11(1): 79.
- Salem JE et al. J Am Coll Cardiol 2019; 74(13): 1667-1678.
- Moreno C et al. Lancet Oncol. 2019;20:43–56.
- Barf T et al. J Pharmacol Exp Ther. 2017;363:240-252.
- Herman SEM Montraveta A, et al. Clin Cancer Res. 2017;23:2831-2841.
- Kaptein A et al. Blood. 2018; 132 (Supplement 1): 1871.
Ältere Patienten: Wie beeinflussen Komorbiditäten die Behandlung der CLL?
Bei der chronischen lymphatischen Leukämie (CLL) liegt das mediane Erkrankungsalter bei Erstdiagnose zwischen 70 und 75 Jahren.<sup>1</sup> Ungefähr 90 % der Patienten sind zum Zeitpunkt der Diagnosestellung über 55 Jahre alt.<sup>2,3</sup> Begleiterkrankungen nehmen mit dem Alter meist zu.
Bei der chronischen lymphatischen Leukämie (CLL) liegt das mediane Erkrankungsalter bei Erstdiagnose zwischen 70 und 75 Jahren.1 Ungefähr 90 % der Patienten sind zum Zeitpunkt der Diagnosestellung über 55 Jahre alt.2,3 Begleiterkrankungen nehmen mit dem Alter meist zu. Daher weist auch der Großteil der CLL- Patienten Komorbiditäten auf, die die körperliche Fitness und somit die Eignung für eine Therapie beeinträchtigen können.8
93 % der Patienten haben bei Diagnose eine oder mehr Komorbiditäten (siehe Abbildung).4 Mittlerweile werden CLL-Patienten in zahlreichen Studien auf Basis eines festgelegten Komorbiditäten-Scores stratifiziert. Basierend auf mehreren Untersuchungen existieren in der Literatur Hinweise darauf, dass Komorbiditäten mit dem Therapieerfolg in direktem Zusammenhang stehen.5,6,7 Die sorgfältige Ermittlung des Komorbiditätsstatus kann sowohl für die Auswahl eines geeigneten Therapieansatzes als auch für die prädiktive Vorhersage der Therapieergebnisse herangezogen werden.6,7
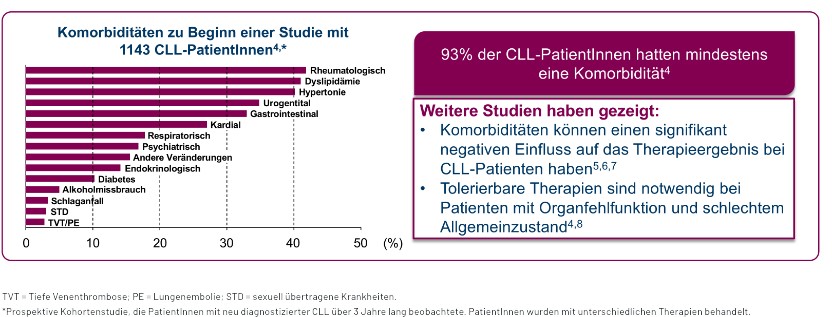
Abbildung 1: Komorbiditäten und ihr Einfluss auf die CLL-Therapie4-8
Was sagen die Leitlinien?
Die Therapiewahl erfolgt nach aktuellen Leitlinien unter anderem basierend auf dem Allgemeinzustand der CLL-Patienten, welcher anhand des Cumulative Illness Rating Scores (CIRS) festgelegt wird.1,14 Dabei wird nach gutem Allgemeinzustand (CIRS < 6), reduziertem Allgemeinzustand (CIRS ≥ 6) und schlechtem Allgemeinzustand (gebrechliche Patienten) differenziert.1 Während bei Patienten mit schlechtem Allgemeinzustand supportive Therapien im Vordergrund stehen, stehen dem behandelnden Arzt bei Patienten mit reduziertem Allgemeinzustand unterschiedliche Therapieansätze zur Wahl:1 Komorbide Patienten sollten bevorzugt eine Primärtherapie mit einem BTK-Inhibitor, wie beispielsweise Acalabrutinib, oder alternativ eine Primärtherapie mit Venetoclax plus Obinutuzumab erhalten. Als Alternative stehen bei Patienten mit mutiertem IGHV-Status oder bei Patienten, die keine Therapie mit einem Signalweginhibitor wünschen oder hierfür ungeeignet sind, alternativ Chemoimmuntherapien zur Verfügung. Bei Älteren und komorbiden CLL-Patienten kann gegebenenfalls eine Dosisreduktion erforderlich sein. Hierbei sollten die Informationen aus der jeweiligen Fachinformation berücksichtigt werden.1
Komorbiditäten und Chemoimmuntherapien
Es gibt mehrere Studien, die darauf hinweisen, dass Komorbiditäten einen Einfluss auf das Therapieergebnis von Chemoimmuntherapien haben. So untersuchte beispielsweise eine Studie die prognostische Relevanz von Komorbiditäten an 335 therapienaiven Patienten, die eine CIT erhielten. Patienten mit gutem Allgemeinzustand wurden mit Fludarabin oder Bendamustin mit oder ohne Rituximab behandelt, während ältere Patienten mit ggf. reduziertem Allgemeinzustand Chlorambucil mit oder ohne Rituximab erhielten. Es zeigte sich, dass Komorbiditäten mit einem schlechteren Therapieergebnis assoziiert sind.9 In der Studie CLL-10 wurden 564 Patienten 1:1 randomisiert und erhielten entweder die CIT Bendamustin plus Rituximab (BR), oder die CIT Fludarabin plus Cyclophosphamid plus Rituximab (FCR). Fitte Patienten (CIRS ≤ 3, max. 1 CIRS-Element, Alter < 65 Jahre) profitierten am meisten von der FCR-Therapie: Die finale Analyse ergab, dass die FCR-Therapie der BR-Therapie in Hinblick auf Minimal Residual Disease (MRD)-Negativität, Complete Response (CR)-Rate, und progressionsfreiem Überleben (PFS) überlegen ist.10 Ältere, fitte Patienten mit zurückliegenden Infektionen könnten jedoch von der BR-Therapie profitieren. Unter FCR- Therapie führten hohe Toxizitäts- und Infektionsraten in älteren, fitten Patienten zu Dosisreduktionen, ein signifikanter Wirksamkeitsvorteil (PFS) gegenüber FCR konnte für diese Patienten nicht gezeigt werden.10
Komorbiditäten und zielgerichtete Therapien
Auch wenn bekannt ist, dass Komorbiditäten die Therapieergebnisse bei Patienten unter CIT negativ beeinflussen können, so ist deren Einfluss auf zielgerichtete Therapien noch weitgehend unerforscht.5 Eine retrospektive Kohortenstudie untersuchte basierend auf Daten aus fünf medizinischen Einrichtungen den Einfluss von Komorbiditäten (CIRS ≥ 7, CIRS-3+) auf die Therapie mit einem Bruton-Tyrosinkinase-Inhibitor bei Patienten mit therapienaiver oder rezidivierender, refraktärer CLL.5 Ein steigender CIRS wurde mit einer erhöhten Rate an Therapieabbrüchen und einer stärkeren Dosisreduktion assoziiert. Zudem wurden ein kürzeres ereignisfreies Überleben und Gesamtüberleben beobachtet.5 Trotzdem zeigt sich in den Vergleichsstudien zielgerichteter Therapien, dass diese auch bei komorbiden Patienten signifikant längere PFS-Raten erzielen, als die klassischen Chemo(immun)therapien11,17, was sich auch in den Leitlinien widerspiegelt.
Wie hängen Komorbiditäten und Therapiewahl allgemein zusammen?
Komorbiditäten können die Therapiewahl beeinflussen, oder gar ein Ausschlusskriterium für bestimmte Therapeutika sein.1,14 So kann bei eingeschränkter Leber- oder Nierenfunktion die Metabolisierung bzw. die Ausscheidung des Arzneistoffs/Biologikums gestört ablaufen und zu Toxizitäten führen. Folglich sollte die Funktionsfähigkeit dieser beiden Organe vor Therapiestart überprüft werden.10 Doch nicht nur die Organfunktionen, sondern auch spezifische (Vor-)Erkrankungen und die damit einhergehende Dauermedikation sollten in die Therapieentscheidung mit einfließen. Bei einer kardiovaskulären Erkrankung ist es beispielsweise ratsam die Nebenwirkungsprofile der verschiedenen Therapeutika hinsichtlich schwerer Blutungsereignisse, Vorhoflimmern oder Kontraindikationen bezüglich der von Patienten angewendeten Medikation zu beachten.14,15,16
Auch sollte hier zwischen Therapien innerhalb einer Substanzklasse unterschieden werden. Für Acalabrutinib zum Beispiel konnte eine hohe in vitro Selektivität und eine geringe Off Target Aktivität in vitro gezeigt werden. Dies könnte möglicherweise der Grund für ein andersartiges Verträglichkeitsprofil im Vergleich zu dem bisher zugelassenen BTKi sein.13,18,19,20
Referenzen
DE-30117