Acalabrutinib versus Zanubrutinib: Zweitgenerations-BTKi im indirekten Vergleich
Knapp 10 Jahre nach Einführung von BTK-Inhibitoren zur Behandlung der CLL ist inzwischen die zweite Wirkstoffgeneration etabliert. Gegenüber dem Erstgenerations-BTKi haben Acalabrutinib und Zanubrutinib ihre Überlegenheit bereits bewiesen. Doch wie schneiden beide im indirekten Vergleich untereinander ab?
Kernpunkte:
- In einer MAIC-Analyse zeigten die beiden Zweitgenerations-BTKi Acalabrutinib und Zanubrutinib eine vergleichbare Wirksamkeit.1
- Das Risiko für unerwünschte Nebenwirkungen war unter Acalabrutinib zum Teil deutlich geringer.1
- Der indirekte Vergleich weist auf ein günstigeres Sicherheitsprofil von Acalabrutinib hin.
Mit Ibrutinib wurde im Jahr 2014 ein neues Wirkprinzip in die Therapie der chronischen lymphatischen Leukämie eingeführt: die Hemmung der Bruton-Tyrosinkinase in malignen B-Lymphozyten. Mit dieser zielgerichteten Behandlungsstrategie trat die herkömmliche Chemoimmuntherapie immer mehr in den Hintergrund. In der aktuellen Onkopedia-Leitlinie wurde sie als Standardtherapie endgültig von den neuen Substanzen abgelöst.2
Zweite BTKi-Generation mit günstigerem Sicherheitsprofil
Entscheidend für den Durchbruch der BTKi im Therapieschema der CLL war die verbesserte Selektivität der Substanzen. Um die Behandlung weiter zu optimieren und insbesondere Sicherheit und Verträglichkeit zu verbessern, wurden nach Ibrutinib neue Wirkstoffe entwickelt, die mit ihrem hochselektiven Bindungsverhalten weniger Nebenwirkungen verursachen. Zu dieser zweiten Generation von BTKi gehören die Substanzen Acalabrutinib und Zanubrutinib. Acalabrutinib (Calquence®) ist seit Ende 2020 zur Behandlung der CLL zugelassen; Zanubrutinib (Brukinsa®) zog im Jahr 2022 nach.
Gegenüber Ibrutinib zeigten beide Wirkstoffe unabhängig voneinander klare Vorteile im Sicherheitsprofil. In den Phase-3-Studien ELEVATE-RR3 und ALPINE4 waren sie im direkten Vergleich mit ihrem Vorgänger bei ähnlicher Wirksamkeit besser verträglich.
Bisher kein Direktvergleich zwischen Calquence® und Brukinsa®
Während die Zweitgenerations-BTKi ihre Überlegenheit gegenüber Ibrutinib somit bereits unter Beweis gestellt haben, fehlt ein direkter Head-to-Head-Vergleich der beiden Newcomer. Um Wirksamkeit und Sicherheit der neuen BTKi dennoch vergleichen zu können, wurde ein indirektes Verfahren herangezogen, die sogenannte MAIC-(Matching-Adjusted Indirect Comparison-)Analyse.
Hintergrundwissen: Matching-Adjusted Indirect Comparison5,6
MAIC-Analysen kommen dann zum Einsatz, wenn keine direkten Vergleichsstudien vorliegen. Sie erlauben einen indirekten Vergleich der Wirksamkeit und Sicherheit von Medikamenten und anderen medizinischer Interventionen. Dazu werden separate Studien gegenübergestellt, deren Patientenpopulationen möglichst ähnlich sind. Um bleibende Unterschiede zu reduzieren und Verzerrungen zu vermeiden, werden individuelle Patientendaten (IPD) einer bestimmten Studie verwendet und anhand aggregierter Daten mit der Vergleichsstudie abgeglichen (Matching). Dadurch werden die Patientencharakteristika trotz heterogener Studienpopulationen angeglichen. Nach dem Matching erfolgt der Vergleich der Studienergebnisse.
MAIC-Analyse Step by Step:
Schritt 1: Matchingvariablen identifizieren
Anhand einer Cox-Regressionsanalyse werden prognostisch relevante Variablen erhoben, die mögliche Effektmodifikatoren sein könnten.
Schritt 2: Patientenmatching
Die individuellen Patientendaten der einen Studie werden nach den gefundenen prognostischen Variablen gewichtet und mit aggregierten Daten der anderen Studie abgestimmt.
Schritt 3: Vergleich von Wirksamkeit und Sicherheit
Nach dem Matching sind die Daten beider Studien weitgehend vergleichbar. Nun können Endpunkte wie das progressionsfreie Überleben (PFS) oder unerwünschte Nebenwirkungen abgeglichen werden.
Schließlich unterscheidet man je nach Vergleichsstudien Analysen mit oder ohne Brückenkomperator, d. h. mit gemeinsamen oder unterschiedlichen Vergleichsarmen. Bei letzteren spricht man auch von sogenannten unanchored MAIC.
Wichtig zu wissen: MAIC-Analysen ersetzen keine Head-to-Head-Studien. Auch nach dem Matching bleiben Limitationen und mögliche Verzerrungen bestehen. Die Ergebnisse sind daher als hypothesengenerierend zu verstehen.
Ähnliche Patientenpopulationen, unterschiedliche Vergleichsarme
Zur Beurteilung von Acalabrutinib versus Zanubrutinib kamen die jeweiligen Head-to-Head-Vergleiche mit Ibrutinib als Vergleichsstudien nicht infrage. Zwar wurden sowohl für ELEVATE-RR als auch für ALPINE Patientinnen und Patienten mit refraktärer CLL oder Rezidiv (R/R-CLL) eingeschlossen. Darüber hinaus unterschieden sich die Populationen in den Studien jedoch deutlich voneinander. So war eine del(17p)- und/oder del(11q)-Mutation Einschlusskriterium bei ELEVATE-RR, während das genetische Risikoprofil bei ALPINE für die Rekrutierung keine Rolle spielte.
In der MAIC-Analyse wurde daher für Acalabrutinib statt ELEVATE-RR die ASCEND-Studie7 herangezogen, die ähnliche Patientencharakteristika wie ALPINE aufweist. Allerdings war die Vergleichsgruppe anders. Bei ASCEND wurde Acalabrutinib mit einer Chemotherapie aus Idelalisib/Bendamustin + Rituximab bei offenem Mutationsstatus verglichen.7 Es handelt sich bei der Gegenüberstellung von ASCEND und ALPINE damit um eine unanchored MAIC mit unterschiedlichen Vergleichsarmen.
Die Vergleichsstudien im Überblick:
a) ASCEND: Phase-3-Studie bei R/R-CLL7
- n = 310, Randomisierung 1 : 1
- Acalabrutinib Monotherapie (n = 155) versus Idelalisib + Rituximab (n = 119) bzw. Bendamustin + Rituximab (n = 36)
- primärer Endpunkt: progressionsfreies Überleben (PFS)
- sekundäre Endpunkte: Gesamtansprechrate (ORR), Gesamtüberleben (OS), Verträglichkeit u. a.
b) ALPINE: Phase-3-Studie bei R/R-CLL oder SLL4
- n = 652, Randomisierung 1 : 1
- Zanubrutinib Monotherape (n = 327) versus Ibrutinib Monotherapie (n = 325)
- primärer Endpunkt: ORR
- sekundäre Endpunkte: PFS, Inzidenz von Vorhofflimmern u. a.
Beim diesjährigen EHA-Kongress wurden die Ergebnisse der MAIC-Analyse vorgestellt.1 Während die beiden Zweitgenerations-BTKi hinsichtlich der Wirksamkeit vergleichbar waren, zeigten sich im Risikoprofil zum Teil deutliche Unterschiede zwischen den Substanzen.1
1. Effektivität: vergleichbare Wirksamkeit von Acalabrutinib und Zanubrutinib
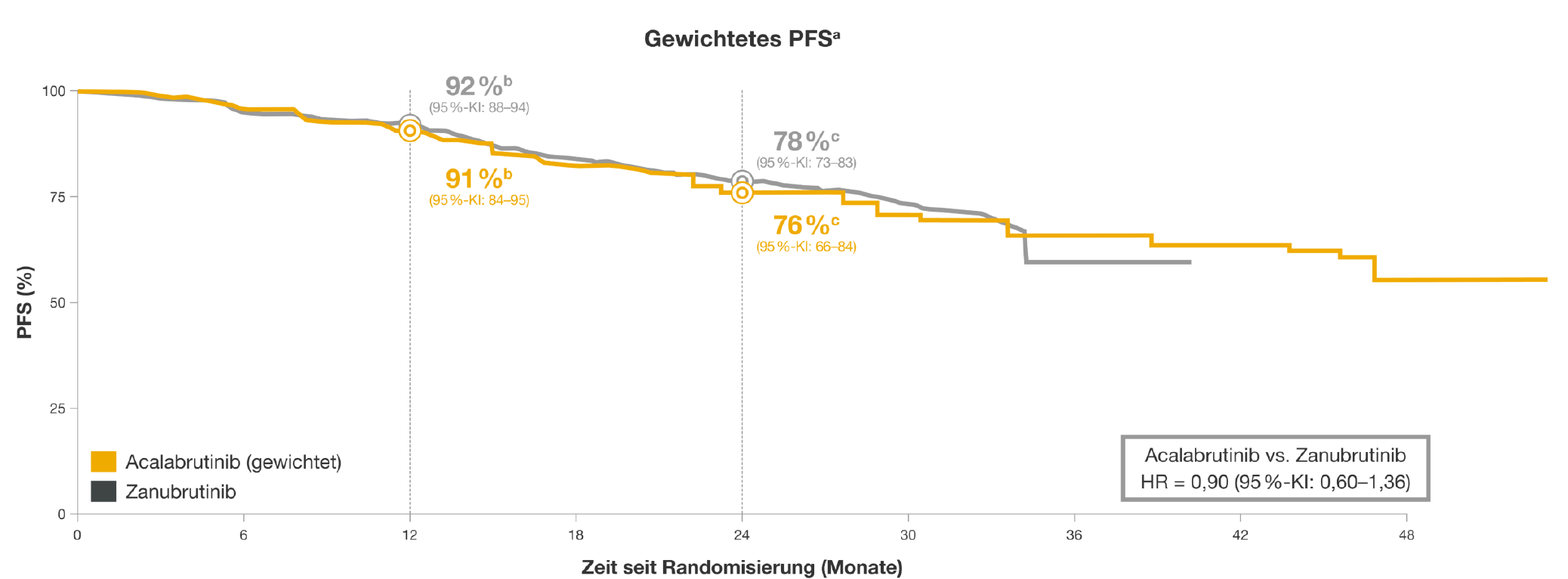
Abbildung 1: PFS unter Acalabrutinib und Zanubrutinib im Vergleich. Adaptiert nach Kittai et al. 20231
a. von Prüfärztinnen und -ärzten beurteilt. b. geschätzte PFS-Rate nach 12 Monaten. c. geschätzte PFS-Rate nach 24 Monaten.
2. Verträglichkeit: Unterschiede bei relevanten Nebenwirkungen
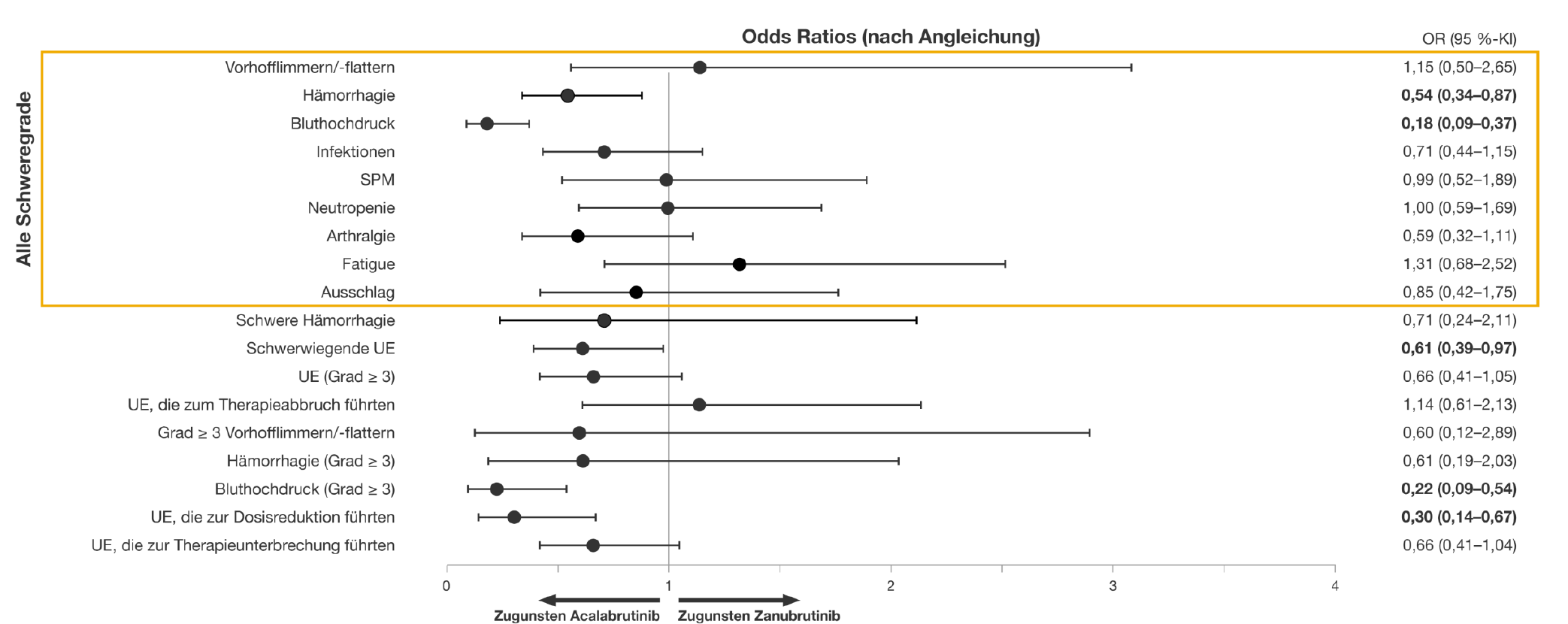
Abbildung 2: Nebenwirkungen unter Acalabrutinib und Zanubrutinib im Vergleich. Adaptiert nach Kittai et al. 20231
Insgesamt traten schwerwiegende Nebenwirkungen unter Acalabrutinib seltener auf als unter Zanubrutinib. Relevante Unterschiede bei unerwünschten Wirkungen zeigten sich darüber hinaus v. a. bei:
- Hämorrhagien (jeden Grades)
- Hypertonie (jeden Grades sowie speziell Grad ≥ 3)
- Dosisreduktion aufgrund von unerwünschten Ereignissen
Hier war Acalabrutinib seinem Vergleichspartner jeweils günstiger.
EHA und ASCO 2023: Stellenwert der neuen BTKi bestätigt
Ob Acalabrutinib oder Zanubrutinib – die Bedeutung der BTK-Inhibitoren der zweiten Generation wurde jüngst auf zwei hochkarätigen Kongressen erneut unterstrichen. Beim diesjährigen ASCO der amerikanischen Gesellschaft für klinische Onkologie herrschte Einigkeit, dass die neuen BTKi mit ihrer höheren Spezifität auch in der Praxis sicherer und verträglicher sind als die Erstsubstanz Ibrutinib und daher vorzugsweise eingesetzt werden sollten.8
Für Dr. Jennifer R. Brown, Hauptautorin der ALPINE-Studie, Department of Medical Oncology, Dana-Farber Cancer Institute, Boston, ist genau dieses verbesserte klinische Outcome der entscheidende Vorteil der zweiten BTKi-Generation.9 Beim europäischen Hämatologenkongress EHA betonte sie: „Aufgrund der kontinuierlichen Therapie mit BTKi bei den meisten B-Zell-Malignitäten ist die langfristige Verträglichkeit und eine niedrige Therapieabbruchquote so wichtig.“9
Welcher Substanz letztlich der Vorzug gegeben wird, liegt – unter Berücksichtigung von Vorerkrankungen und in enger Absprache mit den Betroffenen – im Ermessen des behandelnden Arztes.
Calquence® 100 mg Filmtabletten/Calquence® 100 mg Hartkapseln
▼Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden.
Wirkstoff: Acalabrutinib. Verschreibungspflichtig. Zusammensetzung: Calquence 100 mg Filmtabletten: Jede Filmtablette enthält 100 mg Acalabrutinib (als Acalabrutinibmaleat). Calquence 100 mg Hartkapseln: Jede Hartkapsel enthält 100 mg Acalabrutinib. Sonstige Bestandteile: Calquence 100 mg Filmtabletten: Tablettenkern: Mannitol (Ph.Eur.) (E421), Mikrokristalline Cellulose (E460), niedrig substituierte Hydroxypropylcellulose (E463), Natriumstearylfumarat (Ph.Eur.); Filmüberzug: Hypromellose (E464), Copovidon, Titandioxid (E171), Macrogol (3350), mittelkettige Triglyceride, Eisen(III)-hydroxid-oxid x H2O (E172), Eisen(III)-hydroxid-oxid x H2O (E172). Calquence 100 mg Hartkapseln: Kapselinhalt: Mikrokristalline Cellulose (E460), hochdisperses Siliciumdioxid, vorverkleisterte Stärke (Mais), Magnesiumstearat (E470b), Poly(O-carboxymethyl)stärke-Natriumsalz; Kapselhülle: Gelatine, Titandioxid (E171), Eisen(III)-hydroxid-oxid x H2O (E172), Indigocarmin (E132); Drucktinte: Schellack, Eisen(II,III)-oxid (E172), Propylenglycol (E1520), Ammoniak-Lösung. Anwendungsgebiete: Calquence als Monotherapie oder in Kombination mit Obinutuzumab ist zur Behandlung von erwachsenen Patienten mit nicht vorbehandelter chronischer lymphatischer Leukämie (CLL) indiziert. Calquence als Monotherapie ist zur Behandlung von erwachsenen Patienten mit chronischer lymphatischer Leukämie (CLL) indiziert, die mindestens eine Vorbehandlung erhalten haben. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile. Nebenwirkungen: Monotherapie: Sehr häufig: Infektion der oberen Atemwege, Sinusitis, sekundäre Primärtumoren, Neutropenie, Anämie, Kopfschmerzen, Schwindel, Hämatom, Prellungen, Petechien, Hämorrhagie/Hämatom, Diarrhoe, Übelkeit, Verstopfung, Erbrechen, Abdominalschmerzen, Hautausschlag, muskuloskelettale Schmerzen, Arthralgie, Fatigue, Hämoglobin verringert, absolute Neutrophilenzahl verringert, Thrombozyten verringert. Häufig: Pneumonie, Harnwegsinfektion, Nasopharyngitis, Bronchitis, Herpes-Virus-Infektionen, nichtmelanozytärer Hautkrebs, sekundäre Primärtumoren (ohne nichtmelanozytären Hautkrebs), Thrombozytopenie, Vorhofflimmern/-flattern, Ekchymose, gastrointestinale Blutung, intrakranielle Blutung, Hypertonie, Epistaxis, Asthenie. Gelegentlich: Aspergillus-Infektionen, Hepatitis-B-Reaktivierung, Lymphozytose, Tumorlyse-Syndrom. Kombinationstherapie: Sehr häufig: Infektion der oberen Atemwege, Sinusitis, Nasopharyngitis, Harnwegsinfektion, Pneumonie, sekundäre Primärtumoren, Neutropenie, Thrombozytopenie, Anämie, Kopfschmerzen, Schwindel, Hämatom, Prellungen, Petechien, Hämorrhagie/Hämatom, Hypertonie, Diarrhoe, Übelkeit, Verstopfung, Erbrechen, Abdominalschmerzen, Hautausschlag, muskuloskelettale Schmerzen, Arthralgie, Fatigue, absolute Neutrophilenzahl verringert, Thrombozyten verringert, Hämoglobin verringert. Häufig: Bronchitis, Herpes-Virus-Infektionen, nichtmelanozytärer Hautkrebs, sekundäre Primärtumoren (ohne nichtmelanozytären Hautkrebs), Vorhofflimmern/-flattern, Ekchymose, gastrointestinale Blutung, Epistaxis, Asthenie. Gelegentlich: progressive multifokale Leukoenzephalopathie, Hepatitis-B-Reaktivierung, Lymphozytose, Tumorlyse-Syndrom, intrakranielle Blutung. Sehr selten: Aspergillus-Infektionen. Weitere Hinweise: siehe Fachinformationen. Pharmazeutischer Unternehmer: AstraZeneca GmbH, Friesenweg 26, 22763 Hamburg, E-Mail: azinfo@astrazeneca.com, www.astrazeneca.de, Servicehotline für Produktanfragen: 0800 22 88 660. Stand: August 2023.
DE-61418/2023
- Kittai A et al. A matching-adjusted indirect comparison (MAIC) of the efficacy and safety of acalabrutinib (acala) versus zanubrutinib (zanu) in relapsed or refractory chronic lymphocytic leukemia (RR CLL). J Clin Oncol. 2023;41(suppl 16):7540. doi:10.1200/JCO.2023.41.16_suppl.7540. Präsentiert auf European Hematology Association (EHA) Hybrid Kongress; 08.–11. Juni 2023.
- Wendtner CM et al. Onkopedia-Leitlinie Chronische Lymphatische Leukämie (CLL). Stand: Januar 2023. Online unter: https://www.onkopedia.com/de/onkopedia/guidelines/chronische-lymphatische-leukaemie-cll/@@guideline/html/index.html (letzter Zugriff: Juni 2023).
- Byrd JC et al. Acalabrutinib Versus Ibrutinib in Previously Treated Chronic Lymphocytic Leukemia: Results of the First Randomized Phase III Trial. J Clin Oncol. 2021;39(31):3441–3452 und Supplement.
- Brown JR et al. Zanubrutinib or Ibrutinib in Relapsed or Refractory Chronic Lymphocytic Leukemia. N Engl J Med. 2023 Jan 26;388(4):319-332. doi: 10.1056/NEJMoa2211582. Epub 2022 Dec 13. PMID: 36511784.
- Remiro-Azócar A et al. Methods for population adjustment with limited access to individual patient data: A review and simulation study. Res Synth Methods. 2021 Nov;12(6):750-775. doi: 10.1002/jrsm.1511. Epub 2021 Sep 5. PMID: 34196111.
- Signorovitch JE et al. Matching-adjusted indirect comparisons: a new tool for timely comparative effectiveness research. Value Health. 2012 Sep-Oct;15(6):940-7. doi: 10.1016/j.jval.2012.05.004. PMID: 22999145.
- Ghia P et al. ASCEND: Phase III, Randomized Trial of Acalabrutinib Versus Idelalisib Plus Rituximab or Bendamustine Plus Rituximab in Relapsed or Refractory Chronic Lymphocytic Leukemia. J Clin Oncol 2020;38(25):2849-61.
- ASCO 2023: BTK Inhibitors Differentiated on Safety and Efficacy in CLL. TheMedicalXChange.com. Online unter: https://themedicalxchange.com/en/2023/06/15/2462-btk-inhibitor-cll-sll/ (letzter Zugriff: Juni 2023).
- EHA 2023: Long-term Efficacy in CLL: Expanding Evidence Across Treatment-naïve and Relapsed/Refractory Patients. TheMedicalXChange.com. Online unter: https://themedicalxchange.com/en/2023/06/20/2460_long-term-efficacy-in-cll-expanding-evidence-across-treatment-naive-and-relapsed-refractory-patients/ (letzter Zugriff: Juni 2023).
Abkürzungen:
ASCO = American Society of Clinical Onkologie (bzw. deren Jahreskongress)
BTK = Bruton-Tyrosinkinase
BTKi = Bruton-Tyrosinkinase-Inhibitor
CLL = Chronische lymphatische Leukämie
EHA = European Hematology Association (bzw. deren Jahreskongress)
IPD = individual patient data
ORR = overall response rate
OS = overall survival
PFS = progression-free survival
SLL = small lymphocytic lymphoma
DE-60333/23

